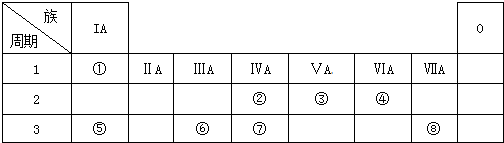
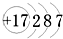4.实验室需用2mol•L-1硫酸铜溶液450mL,配制时应选用称取硫酸铜的质量是( )
| A. | 144.0 g CuSO4 | B. | 144.0 g CuSO4•5H2O | ||
| C. | 225.0 g CuSO4•5H2O | D. | 250.0 g CuSO4•5H2O |
3.对于反应:TiCl4+4Na═4NaCl+Ti,下列说法正确的是( )
| A. | 该反应说明钠是强还原剂,可用于冶炼金属 | |
| B. | 该反应条件是TiCl4在熔融状态或水溶液中 | |
| C. | Ti是氧化产物 | |
| D. | TiCl4是还原剂 |
2.有七种物质:①甲烷、②苯、③聚乙烯、④戊二烯、⑤2-丁炔、⑥环己烷、⑦环己烯,既能使酸性高锰酸钾溶液褪色,又能使溴水因反应而褪色的是( )
| A. | ②③④⑤ | B. | ④⑤⑦ | C. | ①③④⑤ | D. | ④⑤⑥⑦ |
1.常温下,将0.1mol/L的氢氧化钠溶液与0.06mol/L硫酸溶液等体积混合溶液的pH等于( )
| A. | 1.7 | B. | 2.0 | C. | 10 | D. | 12 |
20. 在一定条件下,NO2(g)+CO(g)═NO(g)+CO2(g)反应过程的能量变化如图所示.下列说法错误的是( )
在一定条件下,NO2(g)+CO(g)═NO(g)+CO2(g)反应过程的能量变化如图所示.下列说法错误的是( )
 在一定条件下,NO2(g)+CO(g)═NO(g)+CO2(g)反应过程的能量变化如图所示.下列说法错误的是( )
在一定条件下,NO2(g)+CO(g)═NO(g)+CO2(g)反应过程的能量变化如图所示.下列说法错误的是( )| A. | 该反应是放热反应 | |
| B. | 该反应的反应热△H=-234 kJ/mol | |
| C. | 加入催化剂,使该反应的活化能降低,反应速率加快,同时使该反应的反应热数值减小 | |
| D. | 由图可推出:NO(g)+CO2(g)=NO2(g)+CO(g)△H=+234 kJ/mol |
19.下列水溶液中的电离方程式书写正确的是( )
0 170340 170348 170354 170358 170364 170366 170370 170376 170378 170384 170390 170394 170396 170400 170406 170408 170414 170418 170420 170424 170426 170430 170432 170434 170435 170436 170438 170439 170440 170442 170444 170448 170450 170454 170456 170460 170466 170468 170474 170478 170480 170484 170490 170496 170498 170504 170508 170510 170516 170520 170526 170534 203614
| A. | H2SO4═2H++SO42- | B. | NaHCO3═Na++H++CO32- | ||
| C. | KClO3═K++Cl-+3O2- | D. | NaHSO4═Na++HSO4- |
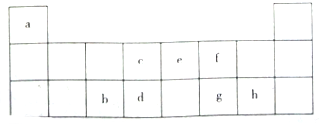 如该表是元素周期表的短周期部分,表中字母分别表示一种元素.请回答下列问题:
如该表是元素周期表的短周期部分,表中字母分别表示一种元素.请回答下列问题: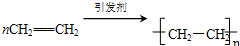 ;
;