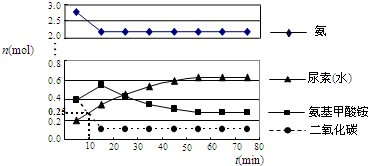
题目内容
16.下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,回答下列问题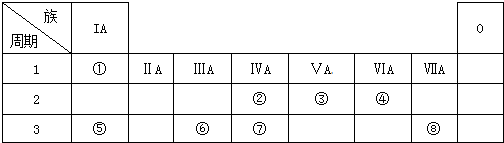
(1)画出⑧的原子结构示意图
(2)④,⑤,⑥的简单离子半径由大到小的顺序是O2->Na+>Al3+(用离子符号表示)
(3)①-⑧的元素中,某元气态氢化物溶于水,溶液呈碱性,原因是NH3•H2O?NH4++OH-(用离子方程式表示)
(4)写出由元素⑥组成的单质与元素⑤最高价氧化物对应的水化物的水溶液反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑
(5)元素②和⑦分别与元素①形成的最简单化合物中的化学键是共价键,其热稳定性CH4>>SiH4(用化学式表示)
分析 由元素在周期表中的位置可知,①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为Cl.
(1)⑧的原子序数是17,根据核外电子排布规律画出其原子结构示意图;
(2)电子层结构相同的阴阳离子,离子半径随着原子序数的增大而减小;
(3)氨气的水溶液呈碱性,是因为一水合氨电离产生氢氧根离子;
(4)铝和氢氧化钠反应产生偏铝酸钠和氢气;
(5)元素②和⑦分别与元素①形成的最简单化合物分别是甲烷、硅烷,同主族元素从上向下氢化物稳定性减弱.
解答 解:(1)⑧的原子序数是17,其原子结构示意图为: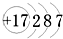 ,
,
故答案为: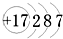 ;
;
(2)电子层结构相同的阴阳离子,离子半径随着原子序数的增大而减小,所以④、⑤、⑥的形成的简单离子半径由大到小的顺序是O2->Na+>Al3+,
故答案为:O2->Na+>Al3+;
(3)氨气的水溶液呈碱性,是因为一水合氨电离产生氢氧根离子,反应的离子方程式为NH3•H2O?NH4++OH-,
故答案为:NH3•H2O?NH4++OH-;
(4)铝和氢氧化钠反应产生偏铝酸钠和氢气,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(5)元素②和⑦分别与元素①形成的最简单化合物分别是甲烷、硅烷,两种分子中都含有共价键,同主族元素从上向下氢化物稳定性减弱,所以其热稳定性CH4>SiH4,
故答案为:共价;CH4;SiH4.
点评 题考查元素周期律和元素周期表,元素的推断是解答本题的关键,学生熟悉元素的性质变化规律及单质、化合物的性质即可解答,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.一定量的乙醛发生银镜反应,析出银21.6g.等量的此醛完全燃烧时,生成的水为( )
| A. | 5.4g | B. | 3.6g | C. | 1.8g | D. | 2.4g |
7.下列物质按纯净物、混合物、电解质、非电解质的顺序组合的一组为( )
| 纯净物 | 混合物 | 电解质 | 非电解质 | |
| A | 蒸馏水 | 氨水 | 氧化铝 | 二氧化硫 |
| B | 盐酸 | 空气 | 硫酸 | 干冰 |
| C | 胆矾 | 盐酸 | 铁 | 碳酸钙 |
| D | 生石灰 | 硫酸 | 氯化铜 | 碳酸钠 |
| A. | A | B. | B | C. | C | D. | D |
4.下列关于胶体和溶液的说法中,正确的是( )
| A. | 许多胶体能进行电泳是因为这些胶体带电 | |
| B. | 布朗运动是胶体粒子特有的运动方式,可以据此把胶体与溶液、悬浊液区分 | |
| C. | 光线通过时,胶体产生丁达尔效应,溶液则无丁达尔效应 | |
| D. | 将饱和氯化铁溶液滴入稀氢氧化钠溶液中加热,可得氢氧化铁胶体 |
11.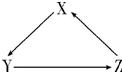 X、Y、Z为中学化学常见物质,其转化关系如下图所示(“→”表示一步转化).下列组合不正确的是( )
X、Y、Z为中学化学常见物质,其转化关系如下图所示(“→”表示一步转化).下列组合不正确的是( )
 X、Y、Z为中学化学常见物质,其转化关系如下图所示(“→”表示一步转化).下列组合不正确的是( )
X、Y、Z为中学化学常见物质,其转化关系如下图所示(“→”表示一步转化).下列组合不正确的是( )| 选项 | X | Y | Z |
| A | Al | Al(OH)3 | Al2O3 |
| B | Na | Na2O2 | NaOH |
| C | H2SO3 | SO2 | H2SO4 |
| D | HCl | Cl2 | HClO |
| A. | A | B. | B | C. | C | D. | D |
1.常温下,将0.1mol/L的氢氧化钠溶液与0.06mol/L硫酸溶液等体积混合溶液的pH等于( )
| A. | 1.7 | B. | 2.0 | C. | 10 | D. | 12 |
6.对于可逆反应M(g)+N(g)?Q(g)达到平衡时,下列说法正确的是( )
| A. | M、N、Q三种物质的浓度一定相等 | |
| B. | M、N全部变成了Q | |
| C. | 反应混合物各成分的百分组成不再变化 | |
| D. | 反应已经停止 |