题目内容
2.有七种物质:①甲烷、②苯、③聚乙烯、④戊二烯、⑤2-丁炔、⑥环己烷、⑦环己烯,既能使酸性高锰酸钾溶液褪色,又能使溴水因反应而褪色的是( )| A. | ②③④⑤ | B. | ④⑤⑦ | C. | ①③④⑤ | D. | ④⑤⑥⑦ |
分析 能使酸性高锰酸钾溶液褪色,又能使溴水因反应而褪色,有机物中含不饱和键(C=C或C≡C),以此来解答.
解答 解:①甲烷与二者均不反应,均不会褪色,故不选;
②苯与二者均不反应,可与溴水发生萃取,故不选;
③聚乙烯中不含不饱和键,与二者均不反应,故不选;
④戊二烯中含C=C,既能使酸性高锰酸钾溶液褪色,又能使溴水因反应而褪色,故选;
⑤2-丁炔中含C≡C,既能使酸性高锰酸钾溶液褪色,又能使溴水因反应而褪色,故选;
⑥环己烷与二者均不反应,可与溴水发生萃取,故不选;
⑦环己烯中含C=C,既能使酸性高锰酸钾溶液褪色,又能使溴水因反应而褪色,故选;
故选B.
点评 本题考查有机物的鉴别,注意信息中的褪色发生氧化与加成反应,明确有机物中含不饱和键是解答的关键,侧重烯烃、炔烃的性质的考查,题目难度不大.

练习册系列答案
相关题目
12.下列物质的分类不正确的是( )
| A. | 水、过氧化氢和干冰都属于氧化物 | B. | H2SO4、HNO3、H2CO3都属于酸 | ||
| C. | 烧碱、纯碱、熟石灰都属于碱 | D. | NaHSO4、CuSO4和KMnO4都属于盐 |
13.已知硫、二氧化硫、三氧化硫三种物质的质量比为2:4:5,它们的物质的量之比为( )
| A. | 2:4:5 | B. | 1:1:1 | C. | 5:4:2 | D. | 1:2:3 |
10.工业制硫酸的一步重要反应是SO2在400~500℃下的催化剂氧化:2SO2+O2?2SO3,这是一个正反应放热的反应,如果反应在密闭容器中进行.下述一个说法中错误的是( )
| A. | 实际生产中鼓入过量的空气,是为了提高SO2的转化率 | |
| B. | 即使在实际生产中鼓入过量的空气,但此过程产生的炉气中仍含有少量SO2 | |
| C. | 此反应中反应物的总能量高于生成物的总能量 | |
| D. | 使用催化剂是为了改变该化学反应的限度 |
7.香港兴建赤鱲角1248公倾新机场,是一个开山填海的庞大工程,共使用烈性炸药“TNT”5600吨.TNT炸药爆炸是时发生如下反应:21O2+4TNT=28CO2+10H2O+6N2则“TNT”的化学式是( )
| A. | C7H5N3O6 | B. | C7H5N3O4 | C. | C5H3NO6 | D. | C7H5NO6 |
14.下列化学反应的离子方程式正确的是( )
| A. | Cu溶于稀HNO3:Cu+2H++NO3-═Cu2++NO2↑+H2O | |
| B. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-═Fe(OH)2↓ | |
| C. | 用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| D. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- |
12.下列有关胶体的说法正确的是( )
| A. | 胶体都是均匀透明的液体 | |
| B. | 胶体粒子能透过半透膜而溶液不能 | |
| C. | 胶体与溶液的本质区别在于粒子直径的大小不同 | |
| D. | 利用丁达尔效应可区别浊液和胶体 |
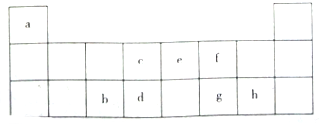 如该表是元素周期表的短周期部分,表中字母分别表示一种元素.请回答下列问题:
如该表是元素周期表的短周期部分,表中字母分别表示一种元素.请回答下列问题: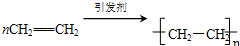 ;
;