1.下列水解反应的应用,不正确的是( )
| A. | CO32-+H2O?HCO3-+OH- 热的纯碱溶液清洗油污 | |
| B. | Al3++3H2O?Al(OH)3 (胶体)+3 H+ 明矾净水 | |
| C. | TiCl4+(x+2)H2O(过量)?TiO2•x H2O+4HCl 用TiCl4制备TiO2 | |
| D. | SnCl2+H2O?Sn(OH)Cl+HCl 配制氯化亚锡溶液时应加入氢氧化钠 |
20.某化学小组合作研究Cl2、Fe3+、Br2的氧化性强弱的顺序.
(1)甲同学根据已有知识,设计并进行下列实验:
①Cl2与NaBr溶液、FeCl2溶液与溴水反应的离子方程式分别为2Br-+Cl2═Br2+2Cl-、2Fe2++Br2=2Fe3++2Br-.
②由上述实验可知Cl2、Fe3+、Br2的氧化性强弱的顺序为Cl2>Br2>Fe3+.
(2)乙同学若用FeBr2溶液与Cl2进行实验,可以用一套装置完成上述实验目的,得出相同结论.乙同学设计并进行下列实验:
①B中反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O.
②开始通入100mL(折合标准状况)Cl2的目的是验证Cl2先氧化Fe2+.
(3)丙同学认为应对乙同学实验现象ⅰ、ⅱ所对应的溶液分别进行进一步验证,才能得出结论.
①丙同学另取100mLFeBr2溶液,通入100mL Cl2,振荡后,分别取2mL溶液于试管c和试管d中,进行实验,请完成下表:
②丙同学认为现象ⅱ中溶液变为棕黄色的原因是Cl2氧化Br-.丙同学设计实验进行验证,记录现象如下:
甲乙丙同学合作探究,证明了Cl2、Fe3+、Br2的氧化性强弱的顺序.
(1)甲同学根据已有知识,设计并进行下列实验:
| 试管 | 操作 | 现象 |
| a | 在试管中加入NaBr溶液,滴加少量氯水,用力振荡后,再加入少量CCl4,振荡静置 | CCl4层由无色逐渐变为橙红色 |
| b | ⅰ.在试管中加入FeCl2溶液,滴加两滴KSCN溶液 ⅱ.加入少量溴水,振荡 | ⅰ.浅绿色溶液无明显变化 ⅱ.溶液变为红色 |
②由上述实验可知Cl2、Fe3+、Br2的氧化性强弱的顺序为Cl2>Br2>Fe3+.
(2)乙同学若用FeBr2溶液与Cl2进行实验,可以用一套装置完成上述实验目的,得出相同结论.乙同学设计并进行下列实验:
| 操作 | A中现象 |
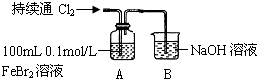 | ⅰ.开始通入100mL(折合标准状况)Cl2,溶液由浅绿色逐渐变黄 ⅱ.继续通入Cl2,溶液黄色加深,当变为棕黄色后,停止通入Cl2 |
②开始通入100mL(折合标准状况)Cl2的目的是验证Cl2先氧化Fe2+.
(3)丙同学认为应对乙同学实验现象ⅰ、ⅱ所对应的溶液分别进行进一步验证,才能得出结论.
①丙同学另取100mLFeBr2溶液,通入100mL Cl2,振荡后,分别取2mL溶液于试管c和试管d中,进行实验,请完成下表:
| 试管 | 操作 | 现象 |
| c | 滴加2-3滴KSCN溶液,振荡 | 溶液变为血红色 |
| d | 加入少量CCl4,振荡,静置 | 出现分层现象,下层为四氯化碳,且呈无色 |
| 试管 | 操作 | 现象 |
| e | 在试管中加入2mL棕黄色溶液,加入少量CCl4,振荡,静置 | CCl4层由无色变为橙红色 |
17.燃料电池是一种高效、环境友好的发电装置.以H2为燃料时,产物为H2O;以CH4为燃料时,产物为H2O和CO2.下列说法不正确的是( )
| A. | H2、CH4在负极失去电子,发生氧化反应 | |
| B. | 从产物推断,两种燃料电池的氧化剂均为O2 | |
| C. | 燃料电池将化学能直接转变为电能,能量转化率高 | |
| D. | 分别将1 mol H2与1 mol CH4做燃料电池的燃料,转移的电子一样多 |
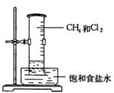
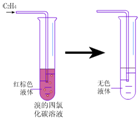
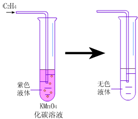
16.下列实验事实能说明苯分子没有与乙烯类似的双键的是( )
①用冰冷却试管中的苯,凝结成无色晶体
②点燃苯,火焰明亮并带有浓烈黑烟
③向试管中加入少量苯,再加入酸性高锰酸钾溶液,振荡后,没有明显变化
④向试管中加入少量苯,再加入溴水,振荡后,上层呈橙红色,下层几乎无色.
①用冰冷却试管中的苯,凝结成无色晶体
②点燃苯,火焰明亮并带有浓烈黑烟
③向试管中加入少量苯,再加入酸性高锰酸钾溶液,振荡后,没有明显变化
④向试管中加入少量苯,再加入溴水,振荡后,上层呈橙红色,下层几乎无色.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
14.下列事实能说明某元素的非金属性比Si强的是( )
0 170173 170181 170187 170191 170197 170199 170203 170209 170211 170217 170223 170227 170229 170233 170239 170241 170247 170251 170253 170257 170259 170263 170265 170267 170268 170269 170271 170272 170273 170275 170277 170281 170283 170287 170289 170293 170299 170301 170307 170311 170313 170317 170323 170329 170331 170337 170341 170343 170349 170353 170359 170367 203614
| 事实 | 非金属性强弱 | |
| A | CH4受热分解的温度比SiH4高 | C>Si |
| B | C与SiO2在高温下反应生成Si和CO | C>Si |
| C | 稀盐酸与Na2SiO3溶液反应生成H2SiO3胶体 | Cl>Si |
| D | H2SO3是中强酸,H2SiO3是弱酸 | S>Si |
| A. | A | B. | B | C. | C | D. | D |

 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.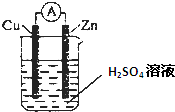 某学习小组针对化学能转变为其他形式的能量,进行如下实验:
某学习小组针对化学能转变为其他形式的能量,进行如下实验: