10.在一定温度下的恒容容器中,当下列物理量不再发生变化时,不能表明反应:A(s)+3B(g)═2C(g)+D(g) 已达平衡状态的是( )
| A. | 混合气体的压强 | B. | 混合气体的密度 | ||
| C. | 3v逆(C)=2v正(B) | D. | 气体的平均相对分子质量 |
8.咖啡鞣酸具有较广泛的抗菌作用,结构简式如图所示:关于咖啡鞣酸的下列叙述不正确的是( )
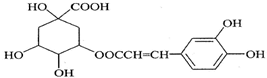
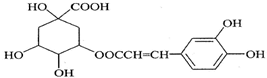
| A. | 分子式为C16H18O9 | |
| B. | 1 mol咖啡鞣酸水解时可消耗8molNaOH | |
| C. | 与苯环上碳直接相连的原子都在同一平面上 | |
| D. | 与浓溴水既能发生取代反应又能发生加成反应 |
7.短周期的三种元素分别为X、Y和Z,已知X元素的原子最外层只有一个电子,Y元素原子的M电子层上的电子数是它的K层和L层电子总数的一半,Z元素原子的L电子层上的电子数比Y元素原子的L电子层上的电子数少2个.则这三种元素所组成的化合物的分子式不可能是( )
| A. | X2YZ4 | B. | XYZ3 | C. | X3YZ4 | D. | X4Y2Z7 |
6.已知β锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质),下面是以锂辉矿为原料来制取金属锂的一种工艺流程.

已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
②Li2CO3在不同温度下的溶解度如下表:
请回答下列问题:
(1)为了提高β锂辉矿浸出率可采取措施有适当提高溶液的温度或粉碎锂辉矿增大接触面积或多次浸出或延长浸出时间或多次搅拌.
(2)反应Ⅰ发生主反应:2LiAlSi2O6+4 H2SO4(浓)1Li2SO4+Al2(SO4)3+4SiO2+4 H2O,根据题意配平上述方程式.
(3)反应Ⅱ加入碳酸钙的作用是除去反应Ⅰ中过量的H2SO4;控制pH,使Fe3+、Al3+完全沉淀.
(4)反应Ⅲ中生成沉淀A成分:Mg(OH)2、CaCO3.(填化学式)
(5)蒸发浓缩过程中主要发生离子反应方程式:2Li++CO32-=Li2CO3↓.
(6)洗涤所得Li2CO3沉淀要使用热水(选填“热水”或“冷水”),你选择的理由是Li2CO3在较高温度下溶解度小,用热水洗涤可减少Li2CO3的损耗.
(7)电解熔融氯化锂生产锂时,阳极产生的Cl2中会混有少量O2,用电极反应式说明原因加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时产生O2,2O2--4e-=O2↑.

已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
(1)为了提高β锂辉矿浸出率可采取措施有适当提高溶液的温度或粉碎锂辉矿增大接触面积或多次浸出或延长浸出时间或多次搅拌.
(2)反应Ⅰ发生主反应:2LiAlSi2O6+4 H2SO4(浓)1Li2SO4+Al2(SO4)3+4SiO2+4 H2O,根据题意配平上述方程式.
(3)反应Ⅱ加入碳酸钙的作用是除去反应Ⅰ中过量的H2SO4;控制pH,使Fe3+、Al3+完全沉淀.
(4)反应Ⅲ中生成沉淀A成分:Mg(OH)2、CaCO3.(填化学式)
(5)蒸发浓缩过程中主要发生离子反应方程式:2Li++CO32-=Li2CO3↓.
(6)洗涤所得Li2CO3沉淀要使用热水(选填“热水”或“冷水”),你选择的理由是Li2CO3在较高温度下溶解度小,用热水洗涤可减少Li2CO3的损耗.
(7)电解熔融氯化锂生产锂时,阳极产生的Cl2中会混有少量O2,用电极反应式说明原因加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时产生O2,2O2--4e-=O2↑.
5.金属钛(Ti)硬度大、熔点高、常温下耐酸碱腐蚀,被誉为“未来金属”.以钛铁矿[主要成分FeTiO3,含FeO、Al2O3、SiO2等杂质]为主要原料冶炼金属钛并获得副产品绿矾(FeSO4•7H2O)的工业生产流程如图1:
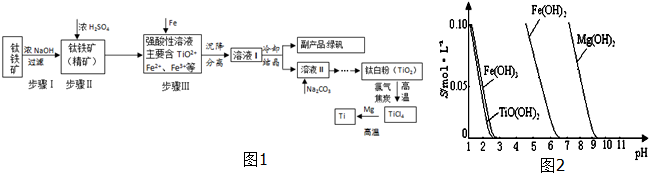
(1)钛铁矿精矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成.试写出反应化学方程式:FeTiO3+H2SO4(浓)=TiOSO4+FeSO4+2H2O;
(2)已知:TiO2+易水解,只能存在于强酸性溶液中. 25℃时,难溶电解质溶解度(s)与pH关系如图2,TiO(OH)2溶度积Ksp=1×10-29,若溶液中残留c(TiO2+)=1.0×10-5 mol•L-1,则调节溶液pH至少为3;步骤Ⅲ加入铁屑原因是将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀.
(3)对溶液Ⅱ进行加热,同时加入Na2CO3粉末的作用加热促进TiO2++2H2O?TiO(OH)2+2H+ 右移,Na2CO3粉末消耗H+,促进TiO2+水解;
(4)钛白粉与氯气、焦炭在高温下进行反应,还生成一种可燃性无色气体,写出该反应的化学方程式
TiO2+2Cl2+2C $\frac{\underline{\;高温\;}}{\;}$ TiCl4+2CO,该生产流程工艺中,可以循环使用的物质为H2SO4(填化学式)
(5)Mg还原TiCl4反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于1412℃即可.
(6)为了测定绿矾中所含结晶水个数,可取样品进行灼烧,在灼烧时需要仪器除了三脚架、坩埚、石棉网、坩埚钳、酒精喷灯外还需要泥三角、玻璃棒.(填仪器名称)

(1)钛铁矿精矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成.试写出反应化学方程式:FeTiO3+H2SO4(浓)=TiOSO4+FeSO4+2H2O;
(2)已知:TiO2+易水解,只能存在于强酸性溶液中. 25℃时,难溶电解质溶解度(s)与pH关系如图2,TiO(OH)2溶度积Ksp=1×10-29,若溶液中残留c(TiO2+)=1.0×10-5 mol•L-1,则调节溶液pH至少为3;步骤Ⅲ加入铁屑原因是将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀.
(3)对溶液Ⅱ进行加热,同时加入Na2CO3粉末的作用加热促进TiO2++2H2O?TiO(OH)2+2H+ 右移,Na2CO3粉末消耗H+,促进TiO2+水解;
(4)钛白粉与氯气、焦炭在高温下进行反应,还生成一种可燃性无色气体,写出该反应的化学方程式
TiO2+2Cl2+2C $\frac{\underline{\;高温\;}}{\;}$ TiCl4+2CO,该生产流程工艺中,可以循环使用的物质为H2SO4(填化学式)
(5)Mg还原TiCl4反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于1412℃即可.
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
4.下列关于煤、石油、天然气等资源的说法正确的是( )
| A. | 石油裂解得到的汽油是纯净物 | |
| B. | 煤的气化是物理变化 | |
| C. | 天然气是一种清洁的化石燃料 | |
| D. | 水煤气是通过煤的液化得到的气体燃料 |
3.在工业生产硫酸的过程中,发生如下反应:2SO2(g)+O2(g)?2SO3(g)+Q,下列叙述中,不正确的是( )
| A. | 矿石粉碎的目的是使原料充分利用,并增大接触面使反应速率加快 | |
| B. | 接触室中采用常压的主要原因是常压下SO2的转化率已经很高 | |
| C. | 沸腾炉中出来的混合气需要洗涤,目的是防止催化剂中毒 | |
| D. | 接触室采用450℃的温度是使催化剂活性最佳,提高平衡混和气中SO3的含量 |
2.短周期元家W、X、Y、Z 的原子序数依次增大,W与Y、X与Z 位于同一主族.W 与X 可形成共价化合物WX2.Y原子的内层电子总数是其最外层电子数的2.5 倍.下列叙述中不正确的是( )
| A. | WX2分子中所有原子最外层都为8 电子结构 | |
| B. | WX2、ZX2的化学键类型相同 | |
| C. | WX2是以极性键结合成的分子 | |
| D. | 原子半径大小顺序为X<W<Y<Z |
1.硅孔雀石的主要成分为CuCO3•Cu(OH)2和CuSiO3•2H2O,还含有SiO2、FeCO3、Fe2O3、Al2O3等杂质.以硅孔雀石为原料制取硫酸铜的工艺流程如下:

部分氢氧化物开始沉淀和完全沉淀的pH如下表
请回答下列问题:
(1)滤渣B的主要成分是Fe(OH)3、Al(OH)3(用化学式表示);判断本实验能否调节溶液pH使杂质完全除去而不损失Cu2+,并简述理由否,铝离子全部沉淀时铜离子有沉淀
(2)用离子方程式表示加入试剂A的作用2Fe2++H2O2+2H+═2Fe3++2H2O
(3)向滤液A中加入bd(填字母)除去杂质最合适.
a.氨水 b.氧化铜 c.氢氧化钠 d.氢氧化铜
(4)从滤液B中提取胆矾的操作包括蒸发浓缩、冷却结晶、过滤、用乙醇洗涤、用滤纸吸干等.
(5)测定产品纯度和胆矾中结晶水数目
①沉淀法测定产品纯度
取一定质量的样品溶于蒸馏水,加入足量的BaCl2溶液和稀硝酸,过滤、洗涤、干燥、称重,实验结果发现测得的产品纯度偏高,可能的原因是acd(填字母)
a.产品失去部分结晶水 b.产品中混有CuCl2•2H2O c.产品中混有Al2(SO4)3•12H2O d.产品中混有Na2SO4
②差量法测得结晶水数目
取ag样品盛装在干燥的坩锅里,灼烧至结晶水全部失去,称得无水硫酸铜的质量b g,则胆矾(CuSO4•nH2O)中n值的表达式为$\frac{80(a-b)}{9b}$.
0 170085 170093 170099 170103 170109 170111 170115 170121 170123 170129 170135 170139 170141 170145 170151 170153 170159 170163 170165 170169 170171 170175 170177 170179 170180 170181 170183 170184 170185 170187 170189 170193 170195 170199 170201 170205 170211 170213 170219 170223 170225 170229 170235 170241 170243 170249 170253 170255 170261 170265 170271 170279 203614

部分氢氧化物开始沉淀和完全沉淀的pH如下表
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 完全沉淀的pH | 5.2 | 3.7 | 9.7 | 6.7 |
(1)滤渣B的主要成分是Fe(OH)3、Al(OH)3(用化学式表示);判断本实验能否调节溶液pH使杂质完全除去而不损失Cu2+,并简述理由否,铝离子全部沉淀时铜离子有沉淀
(2)用离子方程式表示加入试剂A的作用2Fe2++H2O2+2H+═2Fe3++2H2O
(3)向滤液A中加入bd(填字母)除去杂质最合适.
a.氨水 b.氧化铜 c.氢氧化钠 d.氢氧化铜
(4)从滤液B中提取胆矾的操作包括蒸发浓缩、冷却结晶、过滤、用乙醇洗涤、用滤纸吸干等.
(5)测定产品纯度和胆矾中结晶水数目
①沉淀法测定产品纯度
取一定质量的样品溶于蒸馏水,加入足量的BaCl2溶液和稀硝酸,过滤、洗涤、干燥、称重,实验结果发现测得的产品纯度偏高,可能的原因是acd(填字母)
a.产品失去部分结晶水 b.产品中混有CuCl2•2H2O c.产品中混有Al2(SO4)3•12H2O d.产品中混有Na2SO4
②差量法测得结晶水数目
取ag样品盛装在干燥的坩锅里,灼烧至结晶水全部失去,称得无水硫酸铜的质量b g,则胆矾(CuSO4•nH2O)中n值的表达式为$\frac{80(a-b)}{9b}$.
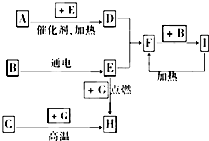 下列是中学化学中常见物质间的反应转化关系图,其中部分产物已略去,常温下,G为固体单质,B、I为液体,其余都为气体.A为化合物,I的浓溶液与G在加热条件下生成F、B和C. H可用作工业上冶炼金属的还原剂.请按要求填空:
下列是中学化学中常见物质间的反应转化关系图,其中部分产物已略去,常温下,G为固体单质,B、I为液体,其余都为气体.A为化合物,I的浓溶液与G在加热条件下生成F、B和C. H可用作工业上冶炼金属的还原剂.请按要求填空: