题目内容
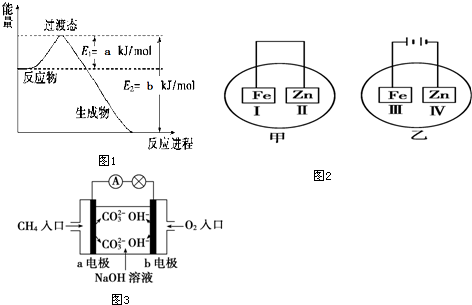
7.短周期的三种元素分别为X、Y和Z,已知X元素的原子最外层只有一个电子,Y元素原子的M电子层上的电子数是它的K层和L层电子总数的一半,Z元素原子的L电子层上的电子数比Y元素原子的L电子层上的电子数少2个.则这三种元素所组成的化合物的分子式不可能是( )| A. | X2YZ4 | B. | XYZ3 | C. | X3YZ4 | D. | X4Y2Z7 |
分析 短周期的三种元素分别为X、Y和Z.Y元素原子的M电子层上的电子数是它K层和L层电子总数的一半,则其M层电子数为5,故Y为P元素;Z元素原子的L电子电子数比Y元素原子的L电子层上电子数少2个,则Z元素L层有6个电子,故Z为O元素;X元素的原子最外层只有一个电子,则X处于ⅠA族,判断可能的化合价,根据化合价可判断可能的化学式.
解答 解:Y元素原子的M电子层上的电子数是它K层和L层电子总数的一半,则M层有5个电子,故Y为P元素,为+3、+5价等;Z元素原子的L电子电子数比Y元素原子的L电子层上电子数少2个,则Z元素L层有6个电子,故Z为O元素,为-2价,X元素的原子最外层只有一个电子,则X处于ⅠA族,X+1价.
A.Y元素化合价为+6价,不符合,故A错误;
B.XYZ3中Y元素化合价为+5价,符合,故B正确;
C.X3YZ4中Y元素化合价为+5价,符合,故C正确;
D.X4Y2Z7中Y元素化合价为+5价,符合,故D正确.
故选A.
点评 本题考查原子结构与元素性质,注意根据原子核外电子排布推断元素种类,并结合化合价判断可能的化合物,题目难度不大.

练习册系列答案
相关题目
12.下列分子中中心原子的杂化方式和分子的空间构型均正确的是( )
| A. | C2H2:sp2、直线形 | B. | SO42-:sp3、三角锥形 | ||
| C. | H3O+:sp3、V形 | D. | BF3:sp2、平面三角形 |
13.硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4═Na2SO4+SO2↑+S↓+H2O下列各组实验中最先出现浑浊的是( )
| A. | 20℃5 mL 0.1 mol•L-1的Na2S2O3溶液,10mL 0.1 mol•L-1的H2SO4溶液,5mL H2O | |
| B. | 20℃5 mL 0.2mol•L-1的Na2S2O3溶液,5 mL 0.2 mol•L-1的H2SO4溶液,10mLH2O | |
| C. | 30℃5mL0.1 mol•L-1的Na2S2O3溶液,10mL 0.1 mol•L-1的H2SO4 溶液,5mLH2O | |
| D. | 30℃5 mL0,2 mol•L-1的Na2S2O3溶液,5 mL 0.2 mol•L-1的H2SO4溶液,10mL H2O |
2.短周期元家W、X、Y、Z 的原子序数依次增大,W与Y、X与Z 位于同一主族.W 与X 可形成共价化合物WX2.Y原子的内层电子总数是其最外层电子数的2.5 倍.下列叙述中不正确的是( )
| A. | WX2分子中所有原子最外层都为8 电子结构 | |
| B. | WX2、ZX2的化学键类型相同 | |
| C. | WX2是以极性键结合成的分子 | |
| D. | 原子半径大小顺序为X<W<Y<Z |
12.短周期非金属元素X和Y能形成XY2型化合物,下列有关XY2的判断不正确的是( )
| A. | XY2一定是分子晶体 | B. | XY2的电子式可能是 | ||
| C. | XY2水溶液不可能呈碱性 | D. | X可能是ⅣA、ⅤA或ⅥA族元素 |
16.下列事实不能用勒沙特列原理解释的是( )
| A. | 合成氨反应:N2(g)+3H2(g)?2NH3(g);△H<0,为使氨的产率提高,理论上应采取低温高压的措施 | |
| B. | 对2HI(g)?H2(g)+I2(g)平衡体系增加压强使颜色变深 | |
| C. | SO2催化氧化成SO3的反应,往往需要使用催化剂 | |
| D. | 已知反应2NO2(g)?N2O4(g),红棕色气体NO2加压后颜色先变深后变浅 |
 .
. ,该晶体中含微粒间的作用有:离子键和非极性键.
,该晶体中含微粒间的作用有:离子键和非极性键.