题目内容
1.硅孔雀石的主要成分为CuCO3•Cu(OH)2和CuSiO3•2H2O,还含有SiO2、FeCO3、Fe2O3、Al2O3等杂质.以硅孔雀石为原料制取硫酸铜的工艺流程如下: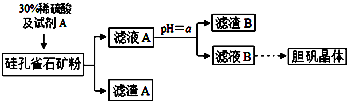
部分氢氧化物开始沉淀和完全沉淀的pH如下表
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 完全沉淀的pH | 5.2 | 3.7 | 9.7 | 6.7 |
(1)滤渣B的主要成分是Fe(OH)3、Al(OH)3(用化学式表示);判断本实验能否调节溶液pH使杂质完全除去而不损失Cu2+,并简述理由否,铝离子全部沉淀时铜离子有沉淀
(2)用离子方程式表示加入试剂A的作用2Fe2++H2O2+2H+═2Fe3++2H2O
(3)向滤液A中加入bd(填字母)除去杂质最合适.
a.氨水 b.氧化铜 c.氢氧化钠 d.氢氧化铜
(4)从滤液B中提取胆矾的操作包括蒸发浓缩、冷却结晶、过滤、用乙醇洗涤、用滤纸吸干等.
(5)测定产品纯度和胆矾中结晶水数目
①沉淀法测定产品纯度
取一定质量的样品溶于蒸馏水,加入足量的BaCl2溶液和稀硝酸,过滤、洗涤、干燥、称重,实验结果发现测得的产品纯度偏高,可能的原因是acd(填字母)
a.产品失去部分结晶水 b.产品中混有CuCl2•2H2O c.产品中混有Al2(SO4)3•12H2O d.产品中混有Na2SO4
②差量法测得结晶水数目
取ag样品盛装在干燥的坩锅里,灼烧至结晶水全部失去,称得无水硫酸铜的质量b g,则胆矾(CuSO4•nH2O)中n值的表达式为$\frac{80(a-b)}{9b}$.
分析 硅孔雀石是一种含铜矿石,含铜形态为CuCO3•Cu(OH)2和CuSiO3•2H2O,同时含有SiO2、FeCO3、Fe2O3、A12O3等杂质,硅孔雀石矿粉加入稀硫酸溶解,加入过氧化氢氧化亚铁离子浸取后过滤,得到滤渣主要为SiO2、H2SiO3,滤液A在含有Cu2+、Fe3+、Al3+、H+,加入铜的化合物调节溶液PH=4使铁离子全部沉淀,此时铝离子有部分沉淀,过滤得到滤液B主要是硫酸铜溶液,含有少量硫酸铝和硫酸溶液,通过蒸发浓缩蒸发,冷却结晶得到硫酸铜晶体;
(1)根据氢氧化物开始沉淀和完全沉淀的pH列表进行分析PH=4完全沉淀、不完全沉淀的离子,依据离子沉淀的PH值分析,铁离子全部沉淀PH=3.7,铝离子全部沉淀PH=5.2,铜离子开始沉淀PH=4.2,铝离子全部沉淀,铜离子液有沉淀,调节溶液pH不能使杂质完全除去而不损失Cu2+;
(2)上述分析可知加入试剂A为氧化亚铁离子为铁离子的氧化剂且不能引入锌的杂质,所以需要加入过氧化氢,双氧水酸性溶液中将亚铁离子氧化成铁离子;
(3)根据滤液A显示酸性,加入的试剂不能引进新的杂质进行分析;
(4)滤液得到溶质晶体的方法是蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铜晶体;
(5)①测得的产品纯度偏高,可能是样品失去结晶水导致样品质量减小,或混入的硫酸根离子和加入的氯化钡生成更多的硫酸钡;
②取ag样品盛装在干燥的坩锅里,灼烧至结晶水全部失去,称得无水硫酸铜的质量b g,结晶水的质量为ag-bg;依据物质的量之比计算n值.
解答 解:(1)步骤中,调节pH=4时,所得滤渣B的成分依据表中数据可知,pH=4时,三价铁离子完全生成了氢氧化铁沉淀,而铝离子完全沉淀需要的PH是5.2,所以铝离子没有完全沉淀,铝离子有少量沉淀,所以渣B的成分为:Fe(OH)3、Al(OH)3 ,依据离子沉淀的PH值分析,铁离子全部沉淀PH=3.7,铝离子全部沉淀PH=5.2,铜离子开始沉淀PH=4.2,铝离子全部沉淀,铜离子液有沉淀,调节溶液pH不能使杂质完全除去而不损失Cu2+,
故答案为:Fe(OH)3、Al(OH)3 ;否,铝离子全部沉淀时铜离子有沉淀;
(2)上述分析可知加入试剂A为氧化亚铁离子为铁离子的氧化剂且不能引入锌的杂质,所以需要加入过氧化氢,双氧水酸性溶液中将亚铁离子氧化成铁离子,双氧水将亚铁离子氧化成铁离子的离子方程式为:2Fe2++H2O2+2H+═2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O;
(3)由于滤液A显示酸性,加入的试剂能够中和溶液中的氢离子,还不能引进新的杂质,所以应该选用氧化铜,碱式碳酸铜,氢氧化铜,等,故选BC,
故答案为:bd.
(4)滤液B为硫酸铜溶液,通过蒸发浓缩、冷却结晶,过滤洗涤等操作可得到硫酸铜晶体;
故答案为:冷却结晶;
(5)①测得的产品纯度偏高,可能是样品失去结晶水导致样品质量减小,或混入的硫酸根离子和加入的氯化钡生成更多的硫酸钡,
a.产品失去部分结晶水导致样品质量减小,使测得的产品纯度偏高,故a正确;
b.产品中混有CuCl2•2H2O对测定纯度无影响,故b错误;
c.产品中混有Al2(SO4)3•12H2O,溶解后生成硫酸钡沉淀质量增大,故c正确;
d.产品中混有Na2SO4,溶解后生成硫酸钡沉淀质量增大,故d正确
故选acd;
②取ag样品盛装在干燥的坩锅里,灼烧至结晶水全部失去,称得无水硫酸铜的质量b g,结晶水的质量为ag-bg;依据物质的量之比计算n值,1:n=$\frac{bg}{160g/mol}$:$\frac{ag-bg}{18g/mol}$,计算得到n=$\frac{80(a-b)}{9b}$,
故答案为:$\frac{80(a-b)}{9b}$.
点评 本题为工艺流程题,考查了方程式的书写、物质分离的方法、有关方程式的计算,主要是铝及其化合物性质的分析应用,掌握基础是关键,题目难度中等.

| A. | CH4和 C3H4,体积比为 1:1 | B. | C2H2和 C2H6,体积比为 3:1 | ||
| C. | C2H4和C2H6,体积比为 2:1 | D. | C2H2和 C2H4,体积比为 2:3 |
| A. | 棉花、羊毛、木材和草类的纤维都是天然纤维,人造毛、人造丝是合成纤维 | |
| B. | 哥本哈根会议重点讨论了地球环境问题,其中破坏臭氧层的氟氯代烷是一类多卤代烃,主要含氟和氯的烷烃衍生物,有的还含有溴原子 | |
| C. | 煤的干馏产物有焦炭、煤焦油、焦炉气、粗氨水和粗苯等 | |
| D. | 肥皂和合成洗涤剂的去污原理相似,固态的合成洗涤剂就是洗衣粉,加入蛋白酶可以提高对血迹、奶迹等蛋白质污物的去污能力 |
已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
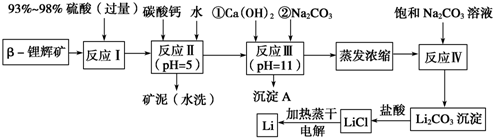
(1)为了提高β锂辉矿浸出率可采取措施有适当提高溶液的温度或粉碎锂辉矿增大接触面积或多次浸出或延长浸出时间或多次搅拌.
(2)反应Ⅰ发生主反应:2LiAlSi2O6+4 H2SO4(浓)1Li2SO4+Al2(SO4)3+4SiO2+4 H2O,根据题意配平上述方程式.
(3)反应Ⅱ加入碳酸钙的作用是除去反应Ⅰ中过量的H2SO4;控制pH,使Fe3+、Al3+完全沉淀.
(4)反应Ⅲ中生成沉淀A成分:Mg(OH)2、CaCO3.(填化学式)
(5)蒸发浓缩过程中主要发生离子反应方程式:2Li++CO32-=Li2CO3↓.
(6)洗涤所得Li2CO3沉淀要使用热水(选填“热水”或“冷水”),你选择的理由是Li2CO3在较高温度下溶解度小,用热水洗涤可减少Li2CO3的损耗.
(7)电解熔融氯化锂生产锂时,阳极产生的Cl2中会混有少量O2,用电极反应式说明原因加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时产生O2,2O2--4e-=O2↑.
检测水中的NO2-可用比色法,其步骤是:
a.配制标准溶液:称取0.30gNaNO2,溶于水后在容量瓶中稀释至1L得溶液A,移取5mL溶液A,稀释至1L,得溶液
b.配制标准色阶:取6只规格为10mL的比色管(即质地、大小、厚薄相同且具塞的平底试管),分别加入体积不等的溶液B,并稀释至10mL,再加入少许(约0.3g)对
苯磺酸粉末,实验结果如下表所示:
| 色阶序号 | 1 | 2 | 3 | 4 | 5 | 6 |
| 加入溶液B的体积(mL) | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 10.0 |
| 反应后溶液颜色 | 由无色变为由浅到深的樱桃红色 | |||||
请填写以下空白:
①比色法的基本依据是溶液颜色的深浅与浓度的大小成正比;
②若水样显色后与色阶中的5号颜色相同,则表明水样中NO2-含量为1.00mg/L.
③用NaNO2直接配制溶液B的缺点是由②计算可知,1L溶液B中只含NO2-1mg,不易称量,直接配溶液B时误差大.
④如果水样显色后比6号还深,应采取的措施是将水样先稀释一定倍数后再重复实验.

| A. | M的相对分子质量是180 | |
| B. | 1 mol M最多能与2 mol Br2发生反应 | |
| C. | M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4 | |
| D. | 1 mol M与足量NaHCO3反应能生成2 mol CO2 |