20.运用化学反应原理研究部分单质及其化合物的反应有重要意义.
(1)氨是氮循环过程中的重要物质,是氮肥工业的重要原料.氨的合成是目前普遍使用的人工固氮方法:N2(g)+3H2(g)?2NH3(g).请回答:
①已知:H-H键能为436kJ/mol,N≡N键能为945kJ/mol,N一H键能为391kJ/mol.由键能计算消耗1molN2时的△H=-93kJ/mol.
②若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡向左移动(填“向左”、“向右”或“不”); 氨气的平衡浓度随温度变化如图所示,当合成氨平衡体系温度由T1变化到T2时,KA>KB(填“>”、“<”或“=”).
③在25°C下,将a mol•L-1的氨水与b mol•L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH4+)=c(Cl-)(填“>”、“<”或“=”);
用含a和b的代数式表示出氨水的电离平衡常数表达式$\frac{10{\;}^{-7}b}{a-b}$.
(2)100℃时,若将0.100mol N2O4气体放入1L密闭容器中,发生反应N2O4?2NO2,c(N2O4)随时间的变化如表所示.回答下列问题:
①在0~40s时段,化学反应速率v(NO2)为0.0025mol•L-1•s-1;
此温度下的化学平衡常数K为0.36.
②下列能说明该反应达到平衡状态的是BD.
A.2v(N2O4)=v(NO2) B.体系的颜色不再改变
C.混合气体的密度不再改变 D.混合气体的压强不再改变
③该反应达到平衡后,降温至50℃,c(N2O4)变为0.080mol•L-1,混合气体的颜色变浅(填“深”或“浅”),该反应的正反应为吸热(填“吸热”或“放热”)反应.
④该反应达平衡后,若只改变一个条件,达新平衡时,下列能使NO2的体积分数增大的是:B
A.充入一定量的NO2 B.增大容器的容积
C.分离出一定量的NO2 D.充入一定量的N2.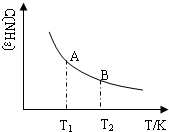
(1)氨是氮循环过程中的重要物质,是氮肥工业的重要原料.氨的合成是目前普遍使用的人工固氮方法:N2(g)+3H2(g)?2NH3(g).请回答:
①已知:H-H键能为436kJ/mol,N≡N键能为945kJ/mol,N一H键能为391kJ/mol.由键能计算消耗1molN2时的△H=-93kJ/mol.
②若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡向左移动(填“向左”、“向右”或“不”); 氨气的平衡浓度随温度变化如图所示,当合成氨平衡体系温度由T1变化到T2时,KA>KB(填“>”、“<”或“=”).
③在25°C下,将a mol•L-1的氨水与b mol•L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH4+)=c(Cl-)(填“>”、“<”或“=”);
用含a和b的代数式表示出氨水的电离平衡常数表达式$\frac{10{\;}^{-7}b}{a-b}$.
(2)100℃时,若将0.100mol N2O4气体放入1L密闭容器中,发生反应N2O4?2NO2,c(N2O4)随时间的变化如表所示.回答下列问题:
| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)/(mol•L-1) | 0.100 | 0.070 | 0.050 | 0.040 | 0.040 | 0.040 |
此温度下的化学平衡常数K为0.36.
②下列能说明该反应达到平衡状态的是BD.
A.2v(N2O4)=v(NO2) B.体系的颜色不再改变
C.混合气体的密度不再改变 D.混合气体的压强不再改变
③该反应达到平衡后,降温至50℃,c(N2O4)变为0.080mol•L-1,混合气体的颜色变浅(填“深”或“浅”),该反应的正反应为吸热(填“吸热”或“放热”)反应.
④该反应达平衡后,若只改变一个条件,达新平衡时,下列能使NO2的体积分数增大的是:B
A.充入一定量的NO2 B.增大容器的容积
C.分离出一定量的NO2 D.充入一定量的N2.

19.已知某化学反应的平衡常数表达式为K=$\frac{c(C{O}_{2})•C({H}_{2})}{c(CO)•c({H}_{2}O)}$,在不同的温度下该反应的平衡常数值分别为:
下列有关叙述不正确的是( )
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
| A. | 该反应的化学方程式是:CO (g)+H2O (g)?CO2 (g)+H2(g) | |
| B. | 上述反应的正反应是放热反应 | |
| C. | 如果在一定体积的密闭容器中加入CO2和H2各1 mol,5 min后温度升高到830℃,此时测得CO2为0.4 mol时,该反应为平衡状态 | |
| D. | 某温度下,如果平衡浓度符合下列关系式:$\frac{c(C{O}_{2})}{3c(CO)}$=$\frac{c({H}_{2}O)}{5c({H}_{2})}$,判断此时的温度是1000℃ |
18.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ•mol-1
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9kJ•mol-1
下列说法正确的是( )
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ•mol-1
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9kJ•mol-1
下列说法正确的是( )
| A. | CH3OH的燃烧热为192.9 kJ•mol-1 | |
| B. | 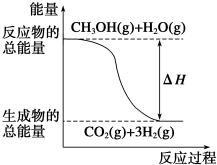 反应①中的能量变化如图所示 | |
| C. | CH3OH转变成H2的过程一定要吸收能量 | |
| D. | 根据②推知反应CH3OH(l)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)的△H>-192.9 kJ•mol-1 |
17.下列关于离子反应及离子共存的说法中正确的是( )
| A. | 能使甲基橙显红色的溶液中,Ba2+、Fe2+、Cl-、NO3-可以大量共存 | |
| B. | AlCl3溶液中加入过量的氨水:Al3++4OH-═[Al(OH)4]- | |
| C. | 常温下,由水电离的c(H+)=10-12mol/L的溶液:K+、Na+、SiO32-、HCO3-可以大量共存 | |
| D. | NaHCO3溶液中滴入少量Ca(OH)2溶液:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O |
12.已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确是( )
①生成物的质量分数一定增加
②生成物的产量一定增大
③反应物的转化率一定增大
④反应物的浓度一定降低
⑤正反应速率一定大于逆反应速率
⑥使用了合适的催化剂.
0 169988 169996 170002 170006 170012 170014 170018 170024 170026 170032 170038 170042 170044 170048 170054 170056 170062 170066 170068 170072 170074 170078 170080 170082 170083 170084 170086 170087 170088 170090 170092 170096 170098 170102 170104 170108 170114 170116 170122 170126 170128 170132 170138 170144 170146 170152 170156 170158 170164 170168 170174 170182 203614
①生成物的质量分数一定增加
②生成物的产量一定增大
③反应物的转化率一定增大
④反应物的浓度一定降低
⑤正反应速率一定大于逆反应速率
⑥使用了合适的催化剂.
| A. | ①② | B. | ②③⑤ | C. | ⑤ | D. | ④⑥ |
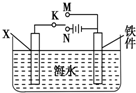 对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命.
对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命.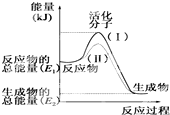 请认真观察如图,然后回答问题:
请认真观察如图,然后回答问题: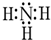 ,分子间存在氢键.
,分子间存在氢键.