2. 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:
操作如下:
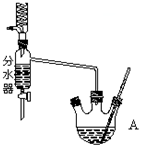
①在50mL三颈烧瓶中投入几粒沸石,将18.5mL正丁醇和13.4mL冰醋酸(过量),3~4滴浓硫酸按一定顺序均匀混合,安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管.
②将分水器分出的酯层和反应液一起倒入分液漏斗中依次用水洗,10% Na2CO3洗,再水洗,最后转移至锥形瓶并干燥.
③将干燥后的乙酸正丁酯加入烧瓶中,常压蒸馏,收集馏分,得15.1g乙酸正丁酯.
请回答有关问题:
(1)写出任意一种正丁醇同类的同分异构体的结构简式CH3CH2CH(OH)CH3.
(2)仪器A中发生反应的化学方程式为CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
(3)步骤 ①向三颈烧瓶中依次加入的药品是:正丁醇,浓硫酸,冰醋酸.
(4)步骤 ②中,用 10%Na2CO3溶液洗涤有机层,该步操作的目的是除去酯中混有的乙酸和正丁醇.
(5)步骤 ③在进行蒸馏操作时,若从118℃开始收集馏分,产率偏高,(填“高”或“低”)原因是会收集到少量未反应的冰醋酸和正丁醇
(6)该实验生成的乙酸正丁酯的产率是65%.
 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度g/l00g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
①在50mL三颈烧瓶中投入几粒沸石,将18.5mL正丁醇和13.4mL冰醋酸(过量),3~4滴浓硫酸按一定顺序均匀混合,安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管.
②将分水器分出的酯层和反应液一起倒入分液漏斗中依次用水洗,10% Na2CO3洗,再水洗,最后转移至锥形瓶并干燥.
③将干燥后的乙酸正丁酯加入烧瓶中,常压蒸馏,收集馏分,得15.1g乙酸正丁酯.
请回答有关问题:
(1)写出任意一种正丁醇同类的同分异构体的结构简式CH3CH2CH(OH)CH3.
(2)仪器A中发生反应的化学方程式为CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
(3)步骤 ①向三颈烧瓶中依次加入的药品是:正丁醇,浓硫酸,冰醋酸.
(4)步骤 ②中,用 10%Na2CO3溶液洗涤有机层,该步操作的目的是除去酯中混有的乙酸和正丁醇.
(5)步骤 ③在进行蒸馏操作时,若从118℃开始收集馏分,产率偏高,(填“高”或“低”)原因是会收集到少量未反应的冰醋酸和正丁醇
(6)该实验生成的乙酸正丁酯的产率是65%.
1.根据下列实验方案设计,不能测定出相关含量的是( )
| A. | 测定某补血剂(成分FeSO4和维生素C)中铁元素的含量,将一定质量的补血剂溶于水,然后用标准浓度的酸性高锰酸钾溶液滴定至溶液恰好变紫色且半分钟不改变 | |
| B. | 测量SO2、N2混合气体中SO2含量,将标准状况下一定体积混合气体通过装有一定浓度一定体积的碘-淀粉溶液的反应直至溶液蓝色恰好消失 | |
| C. | 测定氯化铵与硫酸铵混合物中氯化铵的含量,将一定质量的混合物溶于水,再加入过量氯化钡溶液至沉淀不再生成,过滤、洗涤、干燥,再称重 | |
| D. | 测定硫酸铜晶体(CuSO4•xH2O)里结晶水的含量,将一定质量的硫酸铜晶体加热至蓝色变白,冷却,称量,重复至前后质量恒定 |
20.下列递变规律正确的是( )
| A. | 热稳定性:HCl>HF>H2O | B. | 沸点:金刚石>冰>干冰 | ||
| C. | 碱性:NaOH>Mg(OH)2>Ca(OH)2 | D. | 元素的最高正化合价:F>S>C |
16.过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等.请回答相关问题:
(1)目前常用乙基蒽醌法制备过氧化氢,主要过程如图1,此过程的总方程式为H2+O2$\frac{\underline{\;催化剂\;}}{\;}$H2O2.

(2)实验测得常温下质量分数为0.51%H2O2水溶液(密度为1g/mL)的pH为5
i.写出H2O2溶于水的电离方程式H2O2?H++HO2-HO2-?H++O22-.
ii.测定H2O2水溶液pH的方法为D(填编号)
A.用酸碱指示剂测定 B.用广泛pH试纸测定
C.用精密pH试纸测定 D.用pH计测定
(3)某实验小组拟研究浓度、催化剂、溶液酸碱性对H2O2分解反应速率的影响.在常温下按照如下方案完成实验.
i.实验①和②的目的是探究浓度对反应速率的影响.实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2较稳定,不易分解.为了达到实验目的,你对原实验方案的改进是向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中).
ii.实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图2所示.
分析该图能够得出的实验结论是溶液pH越大,双氧水分解速度越快.
(4)实验室常用酸性高锰酸钾标准溶液测定双氧水的浓度,反应原理为:2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2↑
2MnO4-+H2O2+H+═2Mn2++H2O+O2↑
i.请配平以上离子方程式2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2↑
ii.用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗0.1000mol•L-1的KMnO4标准溶液体积如下表所示:
计算试样中过氧化氢的浓度为0.18mol•L-1.
iii.若滴定前尖嘴中有气泡滴定后消失,则测定结果偏高(“偏高”或“偏低”或“不变”).
(1)目前常用乙基蒽醌法制备过氧化氢,主要过程如图1,此过程的总方程式为H2+O2$\frac{\underline{\;催化剂\;}}{\;}$H2O2.

(2)实验测得常温下质量分数为0.51%H2O2水溶液(密度为1g/mL)的pH为5
i.写出H2O2溶于水的电离方程式H2O2?H++HO2-HO2-?H++O22-.
ii.测定H2O2水溶液pH的方法为D(填编号)
A.用酸碱指示剂测定 B.用广泛pH试纸测定
C.用精密pH试纸测定 D.用pH计测定
(3)某实验小组拟研究浓度、催化剂、溶液酸碱性对H2O2分解反应速率的影响.在常温下按照如下方案完成实验.
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2% H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 10mL 5% H2O2 溶液 | 0.1gMnO2粉末 |
| ④ | 10mL 5% H2O2 溶液+少量HCl溶液 | 0.1gMnO2粉末 |
| ⑤ | 10mL 5% H2O2 溶液+少量NaOH溶液 | 0.1gMnO2粉末 |
ii.实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图2所示.
分析该图能够得出的实验结论是溶液pH越大,双氧水分解速度越快.
(4)实验室常用酸性高锰酸钾标准溶液测定双氧水的浓度,反应原理为:2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2↑
2MnO4-+H2O2+H+═2Mn2++H2O+O2↑
i.请配平以上离子方程式2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2↑
ii.用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗0.1000mol•L-1的KMnO4标准溶液体积如下表所示:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
iii.若滴定前尖嘴中有气泡滴定后消失,则测定结果偏高(“偏高”或“偏低”或“不变”).
15.在CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O的平衡体系中,加入一定量的C2H518OH,当重新达到平衡时,18O原子应存在于( )
0 169870 169878 169884 169888 169894 169896 169900 169906 169908 169914 169920 169924 169926 169930 169936 169938 169944 169948 169950 169954 169956 169960 169962 169964 169965 169966 169968 169969 169970 169972 169974 169978 169980 169984 169986 169990 169996 169998 170004 170008 170010 170014 170020 170026 170028 170034 170038 170040 170046 170050 170056 170064 203614
| A. | 乙酸乙酯中 | B. | 乙酸中 | ||
| C. | 水中 | D. | 乙酸、乙酸乙酯和水中 |
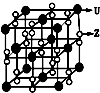 X、Y、Z、U为原子序数依次增大的前四周期元素,X、Y、Z三种元素位于同一周期,其中基态Y原子的2p轨道处于半充满状态,Y和Z的单质可以通过分离液态空气的方法大量制得,且XZ2与Y2Z互为等电子体.含U的化合物的焰色为紫色.试回答下列问题:
X、Y、Z、U为原子序数依次增大的前四周期元素,X、Y、Z三种元素位于同一周期,其中基态Y原子的2p轨道处于半充满状态,Y和Z的单质可以通过分离液态空气的方法大量制得,且XZ2与Y2Z互为等电子体.含U的化合物的焰色为紫色.试回答下列问题: