题目内容
14.现有3.58gNa2CO3 和NaHCO3的固体混合物,将其制成溶液后,边搅拌边逐滴滴加80.0ml 1.0mol/L 盐酸,反应完全后生成的CO2气体折算成标准状况下的体积为896ml(设气体全部逸出,下同).回答下列问题:(1)其中盐酸过量.
(2)固体混合物中Na2CO3 和NaHCO3的物质的量之比为1:3.
(3)取xg上述Na2CO3 和NaHCO3的固体混合物,将其制成溶液后,边搅拌边逐滴滴加40.0ml 1.0mol/L 盐酸,反应完全后生成的CO2气体折算成标准状况下的体积为448ml,则x的值可能为1.79或7.16.
(4)取xg上述Na2CO3 和NaHCO3的固体混合物,将其制成溶液后,边搅拌边逐滴
滴加40.0ml 1.0mol/L 盐酸,反应完全后生成的CO2气体折算成标准状况下的体积为yml,当2.864≤x<14.32时,y与x的函数关系式是y=896-$\frac{11200x}{179}$.
分析 向Na2CO3和NaHCO3的混合溶液中滴加盐酸,首先发生反应Na2CO3+HCl═NaCl+NaHCO3,Na2CO3完全转化为NaHCO3,再发生NaHCO3+HCl═NaCl+CO2↑+H2O,
(1)由方程式Na2CO3+2HCl═2NaCl+CO2↑+H2O、NaHCO3+HCl═NaCl+CO2↑+H2O可知,假定3.58g全部是Na2CO3,完全反应消耗的盐酸最多,n(Na2CO3)=$\frac{3.58g}{106g/mol}$=0.0338mol,消耗盐酸体积为:$\frac{0.0338mol×2}{1mol/L}$=0.0676l=67.6mL<80mL,故盐酸过量;
(2)设Na2CO3和NaHCO3的物质的量分别为xmol、ymol,根据二者质量之和与二氧化碳的物质的量列方程,据此计算解答;
(3)可能有两种情况:①盐酸过量,根据(2)中固体质量与二氧化碳体积关系计算;②HCl是不足量的,即HCl先和混合物中的Na2CO3反应生成NaHCO3,然后再和NaHCO3反应生成CO2,NaHCO3有剩余,根据方程式计算;
(4)40.0mL 1.0mol/L 盐酸,盐酸的物质的量为0.04mol,设Na2CO3和NaHCO3的物质的量分别为n和3n,则x=106×n+84×3n=358n,所以n=$\frac{x}{358}$,
当反应完全后生成的CO2气体折算成标准状况下的体积为ymL,当x=2.864时,n=$\frac{2.864}{358}$mol=0.08mol,混合物中含有0.08mol碳酸钠、0.24mol碳酸氢钠,
则盐酸刚好完全被消耗,生成的气体最多,随着x的量的不断增加,盐酸不足,即部分碳酸氢钠没有反应,生成的气体越来越少,直到x=14.32,不再生成气体,根据:Na2CO3+HCl=NaHCO3+NaCl可知该步反应消耗的盐酸为nmol,生成了nmol NaHCO3,所以反应后生成NaHCO3的物质的量为4nmol,而盐酸的物质的量剩余(0.04-n)mol,根据反应NaHCO3+HCl=CO2↑+H2O+NaCl可知生成CO2的物质的量为:(0.04-n)mol,
将n=$\frac{x}{358}$带入(0.04-n)mol得出y与x的函数关系式.
解答 解:向Na2CO3和NaHCO3的混合溶液中滴加盐酸,首先发生反应Na2CO3+HCl═NaCl+NaHCO3,Na2CO3完全转化为NaHCO3,再发生NaHCO3+HCl═NaCl+CO2↑+H2O,
(1)由方程式Na2CO3+2HCl═2NaCl+CO2↑+H2O、NaHCO3+HCl═NaCl+CO2↑+H2O可知,假定3.58g全部是Na2CO3,完全反应消耗的盐酸最多,n(Na2CO3)=$\frac{3.58g}{106g/mol}$=0.0338mol,消耗盐酸体积为:$\frac{0.0338mol×2}{1mol/L}$=0.0676l=67.6mL<80mL,故盐酸过量,
故答案为:盐酸;
(2)3.58g Na2CO3和NaHCO3固体完全反应,得到CO2气体的物质的量为:$\frac{0.896L}{22.4L/mol}$=0.04mol,设Na2CO3和NaHCO3的物质的量分别为xmol、ymol,则:x+y=0.04、106x+84y=3.58,解得:x=0.01、y=0.03,
故固体混合物中Na2CO3与NaHCO3的物质的量之比为0.01mol:0.03mol=1:3,
故答案为:1:3;
(3)可能有两种情况:①盐酸过量,由(2)中固体质量与二氧化碳体积关系可知:x:3.58g=448mL:896mL,解得:x=1.79g;
②HCl是不足量的,即HCl先和混合物中的Na2CO3反应生成NaHCO3,然后再和NaHCO3反应生成CO2,NaHCO3有剩余,n总(HCl)=0.4L×1.0mol/L=0.04mol,则:
NaHCO3+HCl═NaCl+CO2↑+H2O(后发生)
0.02mol 0.02mol
Na2CO3+HCl═NaCl+NaHCO3,
0.02mol 0.02mol
故则原混合物中Na2CO3为0.02mol,NaHCO3为0.06mol,
则:x=106g/mol×0.02mol+84g/mol×0.06mol=7.16g
故答案为:1.79或7.16;
(4)取xg上述Na2CO3和NaHCO3的固体混合物,将其制成溶液后,边搅拌边逐滴滴加40.0ml 1.0mol/L 盐酸,盐酸的物质的量为0.04mol,
设Na2CO3和NaHCO3的物质的量分别为n和3n,则x=106×n+84×3n=358n,所以n=$\frac{x}{358}$,
当反应完全后生成的CO2气体折算成标准状况下的体积为ymL,当x=2.864时,n=$\frac{2.864}{358}$mol=0.08mol,混合物中含有0.08mol碳酸钠、0.24mol碳酸氢钠,
则盐酸刚好完全被消耗,生成的气体最多,随着x的量的不断增加,盐酸不足,即部分碳酸氢钠没有反应,生成的气体越来越少,直到x=14.32,不再生成气体,根据:Na2CO3+HCl=NaHCO3+NaCl可知该步反应消耗的盐酸为nmol,生成了nmol NaHCO3,所以反应后生成NaHCO3的物质的量为4nmol,而盐酸的物质的量剩下(0.04-n)mol,
根据反应NaHCO3+HCl=CO2↑+H2O+NaCl可知生成CO2的物质的量为:(0.04-n)mol,
所以y与x的函数关系式为:y=(0.04-n)×22.4×1000=(0.04-$\frac{x}{358}$)×22.4×1000=896-$\frac{11200x}{179}$,
故答案为:896-$\frac{11200x}{179}$.
点评 本题考查了混合物反应的计算,题目难度较大,明确发生反应的实质为解答关键,(4)为难点,注意掌握解答方法,试题侧重考查学生的分析、理解能力及化学计算能力.

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案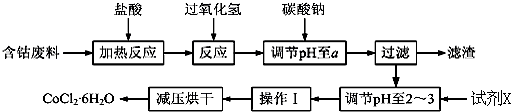
已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2•6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴.
③部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀 | 4.1 | 9.7 | 9.2 | 5.2 |
(1)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为减少有毒气体的排放,防止大气污染;防止产品中混有硝酸盐(写两点).
(2)加入碳酸钠调节pH至a,a的范围是5.2~7.6;pH调至a后过滤,再用试剂X将滤液的pH调节至2-3,则所用的试剂X为盐酸.
(3)操作Ⅰ包含3个基本实验操作,它们是蒸发浓缩、冷却结晶和过滤.
(4)制得的CoCl2•6H2O需减压烘干的原因是降低烘干温度,防止产品分解.
(5)为测定产品中CoCl2•6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量.通过计算发现产品中CoCl2•6H2O的质量分数大于100%,其原因可能是样品中含有NaCl杂质,CoCl2•6H2O烘干时失去了部分结晶水(写出两个原因).
(6)在实验室中,为了从上述产品中获得纯净的CoCl2•6H2O,常将制得的产品溶解于乙醚中,然后过滤、蒸馏(填实验操作)获得纯净的CoCl2•6H2O.
 现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.| A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
| B元素原子的核外p电子总数比s电子总数少1 |
| C原子p轨道上成对电子数等于未成对电子数,且与A同周期 |
| D元素的族序数与周期数的差为4,且不与A元素在同一周期 |
| E位于周期表中第七列 |
| F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子 |
(2)E2+的基态核外电子排布式为1s22s22p63s23p63d5,AD4为非极性(填极性或非极性)分子.
(3)A、B、C三种元素的电负性由小到大的顺序是C<N<O(用元素符号表示),B和C两元素中,B的第一电离能较大的原因是N元素的2p轨道上电子处于半满状态,是一种稳定结构,与AC2互为等电子体的分子的名称为一氧化二氮.(只写一种)
(4)BD3中心原子的杂化方式为sp3杂化,其分子空间构型为三角锥形.
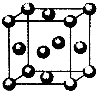
(5)用晶体的x射线衍射法对F的测定得到以下结果:F的晶胞为面心立方最密堆积(如右图),又知该晶体的密度为ρg/cm3,晶胞中该原子的配位数为12;F的原子半径是$\sqrt{2}×\root{3}{\frac{4}{{N}_{A}ρ}}$×1010pm;(阿伏加德罗常数为NA).
| A. | 往新配制的可溶性淀粉溶液中滴加碘水,溶液显蓝色,用CCl4不能从中萃取出碘 | |
| B. | 当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,此现象可作为判断镀锌铁皮中锌镀层是否完全被反应掉的依据 | |
| C. | 制备硫酸亚铁铵晶体时,最后在蒸发皿中蒸发浓缩溶液时,只需小火加热至溶液表面出现晶膜为止,不能将溶液全部蒸干 | |
| D. | 提取海带中碘元素时,为保证I-完全氧化为I2,加入的氧化剂(H2O2或新制氯水)均应过量 |
| A. | 向新制氯水中加入少量CaCO3粉末后,溶液的pH减小 | |
| B. | SO2、CH2═CH2都能使溴水褪色,但原理不同 | |
| C. | NaHCO3、CH3COONH4都能分别和盐酸、烧碱溶液反应 | |
| D. | FeSO4溶液、Na2SO3溶液在空气中都易因氧化而变质 |
| A. | 若在恒温恒压下,当x=1时按1.5 mol A、1molC作为起始物质,平衡后C的体积分数仍为a | |
| B. | 若在恒温恒容下,当x=2时将2molC作起始物质,平衡后C的体积分数仍为a | |
| C. | 若在恒温恒压下,当x=3时1mol A、1mol B、6molC作起始物质,平衡后C的体积分数仍为a | |
| D. | 若在恒温恒容下,按0.6mol A、0.3mol B、1.4molC作起始物质,平衡后C的体积分数仍为a,则x只能等于2 |
| A. | x极为电池的负极 | B. | x极附近溶液的pH值减小 | ||
| C. | y极发生氧化反应 | D. | 电流由y极流向x极 |
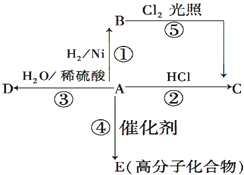 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应.
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应. (反应类型加聚反应 ).
(反应类型加聚反应 ). X、Y、Z、U为原子序数依次增大的前四周期元素,X、Y、Z三种元素位于同一周期,其中基态Y原子的2p轨道处于半充满状态,Y和Z的单质可以通过分离液态空气的方法大量制得,且XZ2与Y2Z互为等电子体.含U的化合物的焰色为紫色.试回答下列问题:
X、Y、Z、U为原子序数依次增大的前四周期元素,X、Y、Z三种元素位于同一周期,其中基态Y原子的2p轨道处于半充满状态,Y和Z的单质可以通过分离液态空气的方法大量制得,且XZ2与Y2Z互为等电子体.含U的化合物的焰色为紫色.试回答下列问题: