8.设NA 为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 16g CH4中含有4NA个C-H键 | |
| B. | 1mol•L-1NaCl溶液含有NA个Na+ | |
| C. | 1 L 0.1 mol•L-1盐酸含有0.1NA个HCl分子 | |
| D. | 1mol Cl2与足量的铁反应,转移的电子总数为2NA个 |
7.如图所示Cu-Zn原电池,下列叙述正确的是( )


| A. | 锌为正极,发生氧化反应 | |
| B. | 铜为负极,铜片溶解 | |
| C. | 电子由铜片通过导线流向锌片 | |
| D. | 铜片上发生的电极反应:2 H++2e-=H2↑ |
5.将煤粉隔绝空气加强热,除主要得到焦炭外,还能得到下表所列的物质:
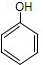
(1)表中所列物质不属于有机物的是(填序号):②⑦,苯酚的俗称为石炭酸.
(2)能与溴水反应使之褪色的烃是(填序号):③.
(3)能发生加聚反应、生成物可用作制造食品包装袋的是(填序号)③,该物质发生加聚反应的化学方程式为nCH2=CH2$\stackrel{催化剂}{→}$
(4)能使酸性高锰酸钾褪色的烃是(填结构简)CH2=CH2、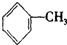 、
、 .
.
(4)彼此互为同系物的是(填序号):④⑤.
(5)甲苯的一氯取代产物的有4种,请写出甲苯的一氯取代产物结构简式: .
.
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 名称 | 甲烷 | 一氧化碳 | 乙烯 | 苯 | 甲苯 | 苯酚 | 氨水 |
(2)能与溴水反应使之褪色的烃是(填序号):③.
(3)能发生加聚反应、生成物可用作制造食品包装袋的是(填序号)③,该物质发生加聚反应的化学方程式为nCH2=CH2$\stackrel{催化剂}{→}$

(4)能使酸性高锰酸钾褪色的烃是(填结构简)CH2=CH2、
 、
、 .
.(4)彼此互为同系物的是(填序号):④⑤.
(5)甲苯的一氯取代产物的有4种,请写出甲苯的一氯取代产物结构简式:
 .
.
2.现有部分短周期元素的性质或原子结构如下表:
(1)用化学用语回答下列问题:
①A元素在周期表中的位置第三周期ⅥA族;
②B元素原子结构示意图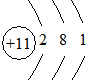 ;
;
③C单质分子的电子式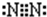 ;用电子式表示A和B元素组成的化合物的形成过程
;用电子式表示A和B元素组成的化合物的形成过程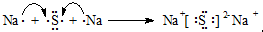 ;
;
④D元素在自然界有两种核素,用原子符号表示其中子数为20的核素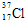 .
.
(2)元素D与元素A相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是bde(填选项序号).
a.常温下D的单质和A的单质状态不同
b.D的氢化物比A的氢化物稳定
c.一定条件下D和A的单质都能与钠反应
d.A的最高价含氧酸酸性弱于D的最高价含氧酸
e.D单质能与A的氢化物反应生成A单质
(3)探寻物质的性质差异性是学习的重要方法之一.A、B、C、D四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种的是NaOH(写化学式).
(4)X是由A、B、C、D四种元素中的某种元素组成的单质,能经下图所示的过程转化为W(其他条件略去).
X$\stackrel{O_{2}}{→}$Y$\stackrel{O_{2}}{→}$Z$\stackrel{H_{2}O}{→}$W
①若Y是有刺激性气味的无色气体,把Y通入BaCl2溶液中,然后滴加适量H2O2溶液,有白色沉淀生成,此白色沉淀的化学式为:BaSO4;生成该白色沉淀的化学方程式为BaCl2+SO2+H2O2=BaSO4↓+2HCl(或Ba2++SO2+H2O2=BaSO4↓+2H+);
②若Z是红棕色气体,则Z→W的反应中氧化剂与还原剂物质的量之比为:1:2.
| 元素编号 | 元素性质或原子结构 |
| A | 有三个电子层,K、M层电子数之和等于L层电子数 |
| B | 短周期中金属性最强 |
| C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
| D | 元素最高正价是+7价 |
①A元素在周期表中的位置第三周期ⅥA族;
②B元素原子结构示意图
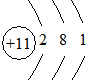 ;
;③C单质分子的电子式
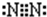 ;用电子式表示A和B元素组成的化合物的形成过程
;用电子式表示A和B元素组成的化合物的形成过程 ;
;④D元素在自然界有两种核素,用原子符号表示其中子数为20的核素
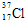 .
.(2)元素D与元素A相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是bde(填选项序号).
a.常温下D的单质和A的单质状态不同
b.D的氢化物比A的氢化物稳定
c.一定条件下D和A的单质都能与钠反应
d.A的最高价含氧酸酸性弱于D的最高价含氧酸
e.D单质能与A的氢化物反应生成A单质
(3)探寻物质的性质差异性是学习的重要方法之一.A、B、C、D四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种的是NaOH(写化学式).
(4)X是由A、B、C、D四种元素中的某种元素组成的单质,能经下图所示的过程转化为W(其他条件略去).
X$\stackrel{O_{2}}{→}$Y$\stackrel{O_{2}}{→}$Z$\stackrel{H_{2}O}{→}$W
①若Y是有刺激性气味的无色气体,把Y通入BaCl2溶液中,然后滴加适量H2O2溶液,有白色沉淀生成,此白色沉淀的化学式为:BaSO4;生成该白色沉淀的化学方程式为BaCl2+SO2+H2O2=BaSO4↓+2HCl(或Ba2++SO2+H2O2=BaSO4↓+2H+);
②若Z是红棕色气体,则Z→W的反应中氧化剂与还原剂物质的量之比为:1:2.
1.有下列10种物质分为两组:
A组:①苯酚,②乙酸,③牛油,④丙氨酸,⑤乙酸乙酯;
B组:⑥溴水,⑦甲醛,⑧苛性钠溶液,⑨氯化铁溶液,⑩金属钠.
A组物质中有一种跟B组物质均能反应,B组物质中有1种跟A组物质均能反应,则这两种物质分别是( )
A组:①苯酚,②乙酸,③牛油,④丙氨酸,⑤乙酸乙酯;
B组:⑥溴水,⑦甲醛,⑧苛性钠溶液,⑨氯化铁溶液,⑩金属钠.
A组物质中有一种跟B组物质均能反应,B组物质中有1种跟A组物质均能反应,则这两种物质分别是( )
| A. | ①⑧ | B. | ③⑩ | C. | ①⑥ | D. | ②⑨ |
20.由-CH3、-OH、 、-COOH 4种基团两两组合而成的有机物中,能跟NaOH溶液发生化学反应的有( )
、-COOH 4种基团两两组合而成的有机物中,能跟NaOH溶液发生化学反应的有( )
 、-COOH 4种基团两两组合而成的有机物中,能跟NaOH溶液发生化学反应的有( )
、-COOH 4种基团两两组合而成的有机物中,能跟NaOH溶液发生化学反应的有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
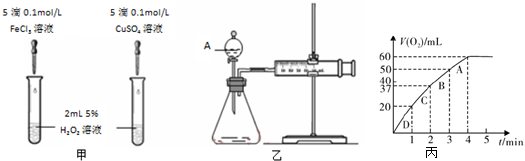
19.下列实验能成功的是( )
0 169822 169830 169836 169840 169846 169848 169852 169858 169860 169866 169872 169876 169878 169882 169888 169890 169896 169900 169902 169906 169908 169912 169914 169916 169917 169918 169920 169921 169922 169924 169926 169930 169932 169936 169938 169942 169948 169950 169956 169960 169962 169966 169972 169978 169980 169986 169990 169992 169998 170002 170008 170016 203614
| A. | 氯乙烷与NaOH溶液共热,在水解后的溶液中加入硫酸,再加入AgNO3溶液检验Cl- | |
| B. | 将电石和水反应后的气体通入溴水中,如果溴水褪色,证明乙炔和溴发生了反应 | |
| C. | 实验室制溴苯时,将苯与液溴混合后加到有铁丝的反应容器中 | |
| D. | 向苯酚浓溶液中滴入少量浓溴水可观察到白色三溴苯酚沉淀 |
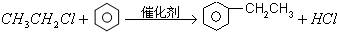
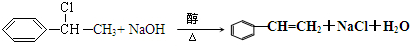
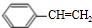 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$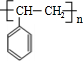 .
.