题目内容
3.海洋约占地球表面积的71%,海水化学资源的利用具有非常广阔的前景.(1)海水晒盐可获得粗盐,在实验室中粗盐经过溶解、过滤、蒸发可制得精盐.
(2)镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的,其主要步骤如下:

①为了使MgSO4转化为Mg(OH)2,试剂①可以选用氢氧化钠,要使MgSO4完全转化为沉淀,加入试剂①的量应过量;
②试剂②可以选用盐酸;
③试从节约能源、提高金属镁的纯度分析,以下适宜的冶镁方法是C.
A.Mg(OH)2$\stackrel{△}{→}$MgO$→_{2800℃}^{电解}$Mg B.Mg(OH)2$\stackrel{△}{→}$MgO$→_{还原}^{C}$Mg
C.Mg(OH)2$\stackrel{HCl}{→}$MgCl2$→_{714℃}^{电解}$Mg D.Mg(OH)2$\stackrel{HCl}{→}$MgCl2$→_{还原}^{活泼金属}$Mg
(3)溴及其化合物用途十分广泛,我国正在大力开展海水提溴的研究和开发工作.工业以浓缩海水为原料提取溴的部分过程如下:
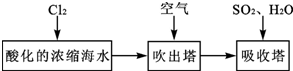
某课外小组在实验室模拟上述过程设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去):
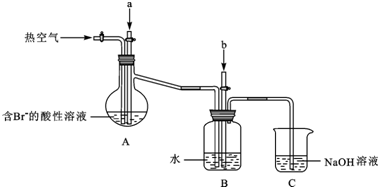
①A装置中通入a气体的目的是(用离子方程式表示)Cl2+2Br-=2Cl-+Br2;
②A装置中通入a气体一段时间后,停止通入,改通热空气.通入热空气的目的是吹出Br2;
③反应过程中,B装置中有SO42-生成.检验SO42-的方法是取少量B装置中反应后的溶液于试管中,滴加氯化钡溶液,产生白色沉淀,证明有SO42-;
④C装置的作用是吸收未反应的Cl2、Br2和SO2.
分析 (1)粗盐提纯的主要步骤是:溶解、过滤、蒸发;
(2)①利用复分解反应及MgSO4转化为Mg(OH)2时阴离子的变化来选择试剂;
②利用复分解反应及Mg(OH)2转化为MgCl2时阴离子的变化来选择试剂;
③MgO的熔点高,制备镁一般利用电解熔融的MgCl2;
(3)由流程可知,氯气与浓缩海水中溴离子发生氧化还原反应生成溴,在吹出塔中富集溴,然后在吸收塔中溴、二氧化硫和水发生氧化还原反应生成硫酸和HBr;由实验装置可知,a为氯气,可氧化溴离子,热空气可将生成的溴蒸气吹出,气体b为二氧化硫,在B装置中发生氧化还原反应生成硫酸和HBr,C装置为尾气处理装置,吸收氯气、二氧化硫、溴等,以此来解答.
解答 解:(1)粗盐提纯的主要步骤是:溶解、过滤、蒸发,
故答案为:过滤、蒸发;
(2)①使MgSO4转化为Mg(OH)2,应选择碱,在转化中不引入新的离子,则试剂①选择过量的NaOH,故答案为:NaOH,过量;
②Mg(OH)2转化为MgCl2时,酸能溶解沉淀,由阴离子可知,试剂②可以选用盐酸,故答案为:盐酸;
③MgO的熔点高,不能利用电解或还原法来制备镁,则ABD错误;适宜的冶镁方法是C,故答案为:C;
(3)①要想使溴离子变成溴单质,则加入的a能和溴离子发生反应生成溴单质,氯气能和溴离子发生置换反应生成溴单质,离子反应方程式为Cl2+2Br-=2Cl-+Br2,
故答案为:Cl2+2Br-=2Cl-+Br2;
②溴易挥发,升高温度促进其挥发,所以通入热空气的目的是吹出Br2,故答案为:吹出Br2;
③使溴蒸气转化为氢溴酸以达到富集的目的,可知气体b为SO2,发生的反应为Br2+SO2+2H2O=2HBr+H2SO4,反应过程中,B装置中有SO42-生成.检验SO42-的方法是取少量B装置中反应后的溶液于试管中,滴加氯化钡溶液,产生白色沉淀,证明有SO42-,
故答案为:取少量B装置中反应后的溶液于试管中,滴加氯化钡溶液,产生白色沉淀,证明有SO42-;
④氯气不可能完全反应,氯气和溴离子反应生成溴单质,未反应的二氧化硫、氯气和溴都有毒,不能直接排空,且这几种物质都能和碱反应,所以C装置是尾气处理装置,可知C的作用为吸收未反应的Cl2、Br2和SO2,
故答案为:吸收未反应的Cl2、Br2和SO2.
点评 本题考查镁的制备,明确海水中镁的制备的流程及试剂的选择来分析解答,注意MgO的熔点高是学生解答中易忽略的地方,制备镁利用电解法,题目中等.

 53随堂测系列答案
53随堂测系列答案①粗盐和酸雨都是混合物
②沼气和水煤气都是可再生能源
③冰和干冰既是纯净物又是化合物
④不锈钢和目前流通的硬币都是合金
⑤盐酸和食醋均既是化合物又是酸
⑥纯碱和熟石灰都是碱
⑦雾、烟都是胶体
⑧利用丁达尔效应可以区分溶液和胶体.
| A. | ①②③④⑥ | B. | ①③④⑦⑧ | C. | ③④⑤⑥⑦ | D. | ①②④⑤⑧ |
| A. | 甲烷 | B. | 正丁烷 | C. | 异丁烷 | D. | 丙烷 |
| A. | 16g CH4中含有4NA个C-H键 | |
| B. | 1mol•L-1NaCl溶液含有NA个Na+ | |
| C. | 1 L 0.1 mol•L-1盐酸含有0.1NA个HCl分子 | |
| D. | 1mol Cl2与足量的铁反应,转移的电子总数为2NA个 |
| A. | 2,5-二甲基-4-乙基己烷 | B. | 2-甲基-1-丁炔 | ||
| C. | 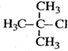 2-甲基-2-氯丙烷 2-甲基-2-氯丙烷 | D. | 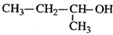 2-甲基-1-丙醇 2-甲基-1-丙醇 |
| A. | C2H2、BeCl2 | B. | SiCl4、NH4+ | C. | H2S、P4 | D. | CH4、BF3 |
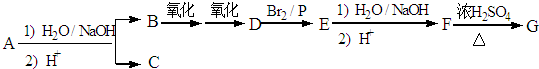
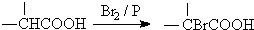
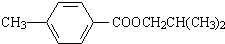 .
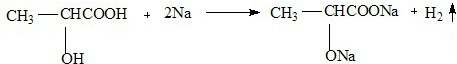
.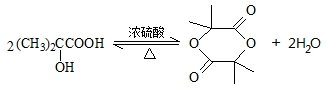 ,该反应属于酯化反应(填反应类型).
,该反应属于酯化反应(填反应类型).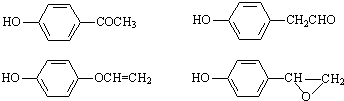 .
. )结构.
)结构. .
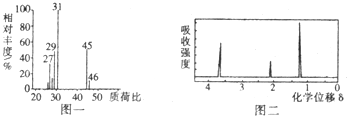
.
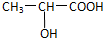
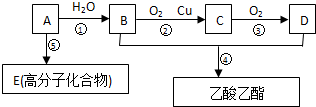
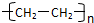

 .
.