4.10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
(1)甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强.乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度大于(填“大于”或“小于”)NaHCO3
(2)丙同学认为甲、乙的判断都不充分.丙认为:
①只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则乙(填“甲”或“乙”)判断正确.试剂X是B.
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清的石灰水
②将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则甲(填“甲”或“乙”)判断正确.
③查阅资料,发现NaHCO3的分解温度为150℃,丙断言乙(填“甲”或“乙”)判断是错误的,理由是常压下加热NaHCO3的水溶液,溶液的温度达不到150℃.
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
(2)丙同学认为甲、乙的判断都不充分.丙认为:
①只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则乙(填“甲”或“乙”)判断正确.试剂X是B.
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清的石灰水
②将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则甲(填“甲”或“乙”)判断正确.
③查阅资料,发现NaHCO3的分解温度为150℃,丙断言乙(填“甲”或“乙”)判断是错误的,理由是常压下加热NaHCO3的水溶液,溶液的温度达不到150℃.
2.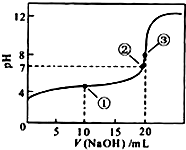 常温下,用0.1000mol•L-1NaOH溶液滴定 20.00mL0.1000mol•L-1CH3COOH溶液所得滴定曲线如图.下列说法正确的是( )
常温下,用0.1000mol•L-1NaOH溶液滴定 20.00mL0.1000mol•L-1CH3COOH溶液所得滴定曲线如图.下列说法正确的是( )
 常温下,用0.1000mol•L-1NaOH溶液滴定 20.00mL0.1000mol•L-1CH3COOH溶液所得滴定曲线如图.下列说法正确的是( )
常温下,用0.1000mol•L-1NaOH溶液滴定 20.00mL0.1000mol•L-1CH3COOH溶液所得滴定曲线如图.下列说法正确的是( )| A. | 点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+) | |
| B. | 点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-) | |
| C. | 点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| D. | 滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(Na+)>c(OH-) |
1.下列叙述能证明某物质是弱电解质的是( )
0 169814 169822 169828 169832 169838 169840 169844 169850 169852 169858 169864 169868 169870 169874 169880 169882 169888 169892 169894 169898 169900 169904 169906 169908 169909 169910 169912 169913 169914 169916 169918 169922 169924 169928 169930 169934 169940 169942 169948 169952 169954 169958 169964 169970 169972 169978 169982 169984 169990 169994 170000 170008 203614
| A. | 水溶液的导电能力很弱 | |
| B. | 溶液中电离出的离子与未电离的分子共存 | |
| C. | 熔化时不导电 | |
| D. | 不是离子化合物而是共价化合物 |
 根据已学知识,请你回答下列问题:
根据已学知识,请你回答下列问题: .
. .
.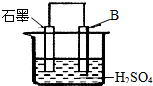 现有A、B、C三种短周期元素,原子序数依次递增.A与C的质子数之和为27,最外层电子数之差为5;0.9g单质B与足量盐酸反应,收集到气体1.12L(标准状况).请回答下列问题:
现有A、B、C三种短周期元素,原子序数依次递增.A与C的质子数之和为27,最外层电子数之差为5;0.9g单质B与足量盐酸反应,收集到气体1.12L(标准状况).请回答下列问题: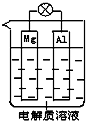 一种原电池的组成如图所示.试回答下列问题(灯泡功率合适):
一种原电池的组成如图所示.试回答下列问题(灯泡功率合适): ;该化合物的晶体类型离子晶体
;该化合物的晶体类型离子晶体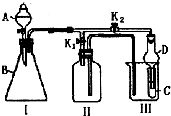 某兴趣小组设计了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质.
某兴趣小组设计了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质.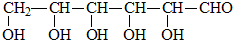 B.CH3CH2OH
B.CH3CH2OH 乳酸 D.
乳酸 D.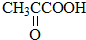 丙酮酸
丙酮酸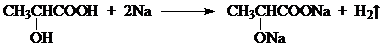 .
.