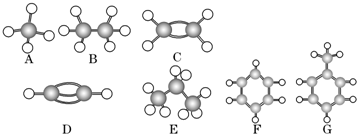
题目内容
5.短周期六元素A、B、C、D、E、F,原子序数依次增大;A、B的阴离子与C、D的阳离子的电子排布式均为ls22s22p6,A原子核外有2个未成对电子,C单质可与热水反应但不能与冷水反应;E、F原子在基态时填充电子的轨道有9个,且E原子核外有3个未成对电子,F能与A形成相同价态的阴离子,且A离子半径小于F离子.回答:(1)写出各元素的符号:AOBF CMgDAlEPFS
(2)写出B与C形成的化合物的电子式
 ;该化合物的晶体类型离子晶体
;该化合物的晶体类型离子晶体(3)请写出元素F的核外电子排布式[Ne]3s23p4;-
(4)上述六种元素按电负性从小到大的排列是Mg<Al<P<S<O<F(写元素符号).
(5)C、D、E、F元素第一电离能最大的是P(写元素符号);
(6)C、D、E、F四种元素中,形成的最高价氧化物对应水化物中(写化学式):酸性最强的是H2SO4 碱性最强的是Mg(OH)2 呈两性的是Al(OH)3.
分析 原子序数依次增大的短周期元素A、B、C、D、E、F,A、B的阴离子与C、D的阳离子的电子排布式均为ls22s22p6,A原子核外有2个未成对电子,则A为O,B为F;C单质可与热水反应但不能与冷水反应,则C为Mg,D为Al,E、F原子在基态时填充电子的轨道有9个,且E原子核外有3个未成对电子,则E为P;F能与A形成相同价态的阴离子,且A离子半径小于F离子,则F和O同主族,且在O的下方,故为S,综上所述:A为氧,B为氟,C为镁,D为铝,E为磷,F为硫,据此进行答题.
解答 解:原子序数依次增大的短周期元素A、B、C、D、E、F,A、B的阴离子与C、D的阳离子的电子排布式均为ls22s22p6,A原子核外有2个未成对电子,则A为O,B为F,C单质可与热水反应但不能与冷水反应,则C为Mg,D为Al,E、F原子在基态时填充电子的轨道有9个,且E原子核外有3个未成对电子,则E为P,F能与A形成相同价态的阴离子,且A离子半径小于F离子,则F和O同主族,且在O的下方,故为S,综上所述:A为氧,B为氟,C为镁,D为铝,E为磷,F为硫,
(1)由上面的分析可知,A为O;B为F;C为Mg;D为Al;E为P;F为S,
故答案为:O;F;Mg;Al;P;S;
(2)写B与C形成的化合物为氟化镁,氟化镁为离子化合物,其电子式为: ,氟化镁晶体为离子晶体,
,氟化镁晶体为离子晶体,
故答案为: ;离子晶体;
;离子晶体;
(3)F为硫,它的简化电子排布式为:[Ne]3s23p4,
故答案为:[Ne]3s23p4;
(4)根据元素周期律,同周期元素从左向右电负性增大,同主族元素从上向下,电负性减弱,所以六种元素按电负性从小到大的排列是:Mg<Al<P<S<O<F,
故答案为:Mg<Al<P<S<O<F;
(5)Mg、Al、P、S元素第一电离取决于金属性的强弱,金属性越强,第一电离能越小,非金属性越强,第一电离能越大,则第一电离能最大的为P,
故答案为:P;
(6)元素的金属性越强,元素的最高价氧化物对应水化物的碱性越强,元素的非金属性越强,元素的最高价氧化物对应水化物的酸性越强,所以在C、D、E、F四种元素中,形成的最高价氧化物对应水化物中,酸性最强的是H2SO4,碱性最强的是 Mg(OH)2,呈两性的是Al(OH)3,
故答案为:H2SO4;Mg(OH)2;Al(OH)3.
点评 本题主要考查了位置、结构与性质关系的综合应用,题目难度中等,元素推断是解题的关键,试题知识点较多、综合性较强,充分考查学生的分析能力及灵活应用能力,注意熟练掌握元素周期表结构、元素周期律内容.

| A. | a:(b+c+d)=1:1.5 | B. | (a+b):(c+d)=1:1 | C. | a=b=c=d=1.12L | D. | a+b+c=d=0.2mol |
| A. | HCO的结构式:H-O-Cl | B. | H2O2的电子式 | ||
| C. | CO2的比例模型 | D. | ${\;}_{8}^{18}{O}^{2-}$离子结构示意图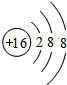 |
| A. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(g)△H=-48.40 kJ•mol-1 | |
| B. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(l)△H=-5 517.6 kJ•mol-1 | |
| C. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(g)△H=+5 517.6 kJ•mol-1 | |
| D. | 2C8H18(l)+25O2(g)═16CO2(g)+18 H2O(l)△H=-5 517.6 kJ•mol-1 |
| A. | 苯与溴水混合,振荡静置,溴水层褪色 | |
| B. | 乙烯通入酸性髙锰酸钾溶液中,溶液褪色 | |
| C. | 乙烯通入溴的四氛化碳溶液中,溶液褪色 | |
| D. | 甲烷与氯气混合光照,气体颜色变浅 |
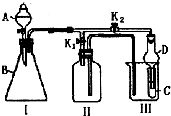 某兴趣小组设计了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质.
某兴趣小组设计了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质.
 ;该元素还可与元素①形成10电子的气体分子Y,将过量的Y气体通入盛有含⑩元素的硫酸盐溶液中,反应过程中的实验现象为:先产生蓝色沉淀,后沉消失,变成深蓝色的溶液;反应过程中的离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-
;该元素还可与元素①形成10电子的气体分子Y,将过量的Y气体通入盛有含⑩元素的硫酸盐溶液中,反应过程中的实验现象为:先产生蓝色沉淀,后沉消失,变成深蓝色的溶液;反应过程中的离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-