题目内容
20. 某兴趣小组设计了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质.
某兴趣小组设计了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质.(1)利用I、Ⅱ装置可制取收集气体(K2关闭,K1打开)
①下列各组物质中能直接利用这套装置进行实验的是AC (填正确选项的标号)
A.锌和稀硫酸B.双氧水和二氧化锰C.浓氨水和氧化钙D.浓盐酸和二氧化锰
②在不改变I、II装置及位置的前提下,若要制取收集NO气体,可采取的改进方法是装置II内充满水;若要制取收集NO2气体,可采取的改进方法是:将Ⅱ装置加满(难挥发的)有机溶剂.
(2)利用I、III装置可验证物质的性质(K2打开,K1关闭)
①若要证明氧化性:KMnO4>C12>Br2,则A中加浓盐酸,B中加KMnO4,C中发生的离子反应方程式Cl2+2Br-=2Cl-+Br2.
②若要证明乙炔为不饱和烃,则I中发生的化学反应方程式为:CaC2+2H2O→Ca(OH)2+C2H2↑.C中的现象为溴水褪色或高锰酸钾溶液褪色.
(3)装置Ⅲ中使用球形干燥管D可防止液体倒吸,其原因是当气体被吸收时,液体上升到球形管中,由于球形管容积较大,导致试管中液面明显下降,使球形管口脱离液面,球形管中的液体又流回试管中,从而防止了倒吸.
分析 (1)①根据反应装置、气体收集装置的特点选择;
②根据二氧化氮的性质选取试剂;
(2)①根据氯气和溴之间的置换反应判断氧化性强弱,并写出相应的离子方程式;
②根据碳化钙和水的反应写出相应的方程式;根据乙炔与溴水或酸性高锰酸钾反应的现象判断;
(3)根据球形干燥管的特点分析.
解答 解:(1)①根据I装置知,反应物反应时不需加热,所以D排除;根据Ⅱ装置知,反应生成的气体密度小于空气的密度,所以排除B,符合条件的是AC,
故答案为:AC;
②二氧化氮能和水反应,所以不能用排水法收集,可将Ⅱ装置加满(难挥发的)有机溶剂来收集二氧化氮气体.
故答案为:将Ⅱ装置加满(难挥发的)有机溶剂;
(2)①氯气能和溴化物置换出溴单质Cl2+2Br-=2Cl-+Br2,从而确定氯气的氧化性大于溴的氧化性,
故答案为:Cl2+2Br-=2Cl-+Br2;
②碳化钙和水反应生成氢氧化钙和乙炔,CaC2+2H2O→Ca(OH)2+C2H2↑;溴或酸性高锰酸钾有强氧化性,能氧化乙炔,所以乙炔能使溴水或高锰酸钾溶液褪色,
故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑;溴水褪色或高锰酸钾溶液褪色;
(3)因为当气体被吸收时,液体上升到球形管中.由于球形管容积较大,导致试管中液面明显下降,使球形管口脱离液面,球形管中的液体又流回试管中,从而防止了倒吸,
故答案为:当气体被吸收时,液体上升到球形管中,由于球形管容积较大,导致试管中液面明显下降,使球形管口脱离液面,球形管中的液体又流回试管中,从而防止了倒吸.
点评 本题考查了实验装置的综合及应用,题目难度中等,涉及装置特点及使用方法、离子方程式、化学方程式书写等知识,注意掌握常见仪器装置的特点及使用方法,试题培养了学生的化学实验能力.

练习册系列答案
相关题目
11.下列各组物质气化或熔化时,所克服的微粒间的作用力,属同种类型的是( )
| A. | 氯化钠和铁的熔化 | B. | 二氧化硅和生石灰的熔化 | ||
| C. | 碘和干冰的升华 | D. | 食盐和冰的熔化 |
8.下列选用的相关仪器及基本操作符合实验要求的是( )
| A. | 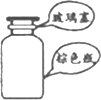 存放浓硝酸 | B. |  向试管中滴加液体 | ||
| C. | 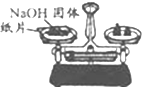 称量NaOH固体 | D. | 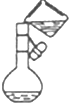 配制溶液时转移溶液 |
9.下列说法中正确的是( )
| A. | 40g SO3气体所占有的体积为11.2L | |
| B. | 1mol固体NaHCO3所含有的阴阳离子总数为3NA | |
| C. | 1mol/L的CH3COOH溶液中,CH3COO-总数小于NA | |
| D. | 常温常压下,32gO2和O3的混合气体含氧原子数为2NA |
10.从海水中提取溴的主要工艺流程有
(1)向酸化的海水中通入适量的氯气,使溴离子转化为单质溴:2NaBr+Cl2═Br2+2NaCl
(2)向吸收塔内的溶液中通入适量的氯气:2HBr+Cl2═2HCl+Br2
(3)蒸馏法将海水浓缩,用硫酸将浓缩的海水酸化
(4)向含有溴单质的水溶液中通入空气和水蒸气,将溴单质吹入盛有二氧化硫溶液的吸收塔内以达到富集的目的:Br2+SO2+2H2O═2HBr+H2SO4
(5)用四氯化碳(或苯)萃取吸收塔内的溶液中的溴单质.
正确的顺序是( )
(1)向酸化的海水中通入适量的氯气,使溴离子转化为单质溴:2NaBr+Cl2═Br2+2NaCl
(2)向吸收塔内的溶液中通入适量的氯气:2HBr+Cl2═2HCl+Br2
(3)蒸馏法将海水浓缩,用硫酸将浓缩的海水酸化
(4)向含有溴单质的水溶液中通入空气和水蒸气,将溴单质吹入盛有二氧化硫溶液的吸收塔内以达到富集的目的:Br2+SO2+2H2O═2HBr+H2SO4
(5)用四氯化碳(或苯)萃取吸收塔内的溶液中的溴单质.
正确的顺序是( )
| A. | (1)(2)(3)(4)(5) | B. | (3)(1)(4)(2)(5) | C. | (5)(1)(3)(2)(4) | D. | (5)(4)(3)(2)(1) |

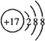 ;
;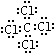 ,分子内含有极性键.
,分子内含有极性键. ;该化合物的晶体类型离子晶体
;该化合物的晶体类型离子晶体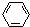 、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.
、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.