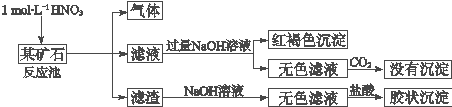
题目内容
2.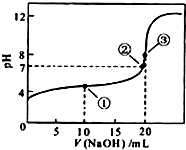 常温下,用0.1000mol•L-1NaOH溶液滴定 20.00mL0.1000mol•L-1CH3COOH溶液所得滴定曲线如图.下列说法正确的是( )
常温下,用0.1000mol•L-1NaOH溶液滴定 20.00mL0.1000mol•L-1CH3COOH溶液所得滴定曲线如图.下列说法正确的是( )| A. | 点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+) | |
| B. | 点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-) | |
| C. | 点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| D. | 滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(Na+)>c(OH-) |
分析 A.根据点①反应后溶液是CH3COONa与CH3COOH物质的量之比为1:1的混合物,溶液呈酸性,说明CH3COOH电离程度大于CH3COO-的水解程度,则c(Na+)>c(CH3COOH),结合电荷守恒进行判断;
B.点②pH=7,即c(H+)=c(OH-),根据电荷守恒可知c(Na+)=c(CH3COO-);
C.点③体积相同,则恰好完全反应生成CH3COONa,利用盐的水解来分析溶液呈碱性,则c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
D.在滴定中当加入碱比较少时,可能出现c(CH3COOH)>c(CH3COO-)>c(Na+)>c(OH-)的情况.
解答 解:A.点①反应掉一半醋酸,反应后溶液是CH3COONa与CH3COOH物质的量之比为1:1的混合物,CH3COOH电离程度大于CH3COO-的水解程度,故c(Na+)>c(CH3COOH),由电荷守恒c(CH3COO-)+c(OH-)=c(Na+)+c(H+)可知:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+),故A错误;
B.点②pH=7,即c(H+)=c(OH-),由电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-)可知:c(Na+)=c(CH3COO-),故B错误;
C.点③说明两溶液恰好完全反应生成CH3COONa,因CH3COO-水解,且程度较小,c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故C错误;
D.当CH3COOH较多,滴入的碱较少时,则生成CH3COONa少量,可能出现c(CH3COOH)>c(CH3COO-)>c(Na+)>c(OH-),故D正确;
故选D.
点评 本题考查离子浓度大小比较,题目难度中等,明确混合后溶液中的溶质是解答的关键,注意电荷守恒和物料守恒的应用,试题培养了学生灵活应用能力.

| A. | Cl2-湿润的KI淀粉试纸-红色 | B. | NH3-湿润的蓝色石蕊试纸-红色 | ||
| C. | NH3-湿润的PH试纸-红色 | D. | NO2-湿润的KI淀粉试纸-蓝色 |
| A. | 标准状况下,22.4L苯的分子数约为NA个 | |
| B. | 常温下,在1moLC5H12中含有共价键数15NA | |
| C. | 标准状况下,17g NH3所含共价键数为NA个 | |
| D. | 常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA |
| A. | 丙烯酸 | B. | 甲酸乙酯 | C. | 甲苯 | D. | 乙酸 |
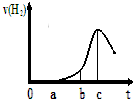 某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol•L-1的硫酸溶液中,下图为反应产生氢气速率与反应时间的关系图.
某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol•L-1的硫酸溶液中,下图为反应产生氢气速率与反应时间的关系图. 现有A、B、C三种短周期元素,原子序数依次递增.A与C的质子数之和为27,最外层电子数之差为5;0.9g单质B与足量盐酸反应,收集到气体1.12L(标准状况).请回答下列问题:
现有A、B、C三种短周期元素,原子序数依次递增.A与C的质子数之和为27,最外层电子数之差为5;0.9g单质B与足量盐酸反应,收集到气体1.12L(标准状况).请回答下列问题: