题目内容
7.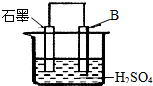 现有A、B、C三种短周期元素,原子序数依次递增.A与C的质子数之和为27,最外层电子数之差为5;0.9g单质B与足量盐酸反应,收集到气体1.12L(标准状况).请回答下列问题:
现有A、B、C三种短周期元素,原子序数依次递增.A与C的质子数之和为27,最外层电子数之差为5;0.9g单质B与足量盐酸反应,收集到气体1.12L(标准状况).请回答下列问题:(1)B元素在元素周期表中的位置是第三周期 IIIA族
(2)A、B、C三种元素最高价氧化物对应的水化物酸性渐强、碱性渐弱的顺序是(写化学式)NaOH、Al(OH)3、H2SO4
(3)A、B两元素的最高价氧化物对应的水化物之间可以发生反应,其离子方程式为Al(OH)3+OH-=AlO2-+2H2O
(4)将B单质与石墨按图装置连接,石墨电极的名称为正极;另一电极反应式为:Al-3e-=Al3+.
(5)C的一种氧化物是常见的大气污染物.为防止大气污染,某化工厂用NaOH溶液、石灰和O2处理含C的上述氧化物的尾气,使其转化为石膏(CaSO4•2H2O).假设在转化过程中C元素不损失,每天处理1120m3(标准状况下)含2%(体积分数)上述氧化物的尾气,理论上可以得到多少千克石膏?
分析 假设AB在同周期,则B+A=27,B-A=5,可得B=16,A=11即A为钠、B为硫;假设AB不在同周期,则B+A=27,B-A=5+8,可得B=20(超出短周期舍去),A故A为Na,C为S,设B的化合价为+x价,
2B+2xHCl=2BClx+xH2
2M 22.4x
0.9 1.12
M=9x,B能与盐酸反应,所以x可取1、2、3,分别代入可知M=9x,当x=3时,M=27,B为Al,x取代1和2时都没有对应的金属,据此答题.
解答 解:假设AB在同周期,则B+A=27,B-A=5,可得B=16,A=11即A为钠、B为硫;假设AB不在同周期,则B+A=27,B-A=5+8,可得B=20(超出短周期舍去),A故A为Na,C为S,设B的化合价为+x价,
2B+2xHCl=2BClx+xH2
2M 22.4x
0.9 1.12
M=9x,B能与盐酸反应,所以x可取1、2、3,分别代入可知M=9x,当x=3时,M=27,B为Al,x取代1和2时都没有对应的金属,
故A为Na,B为Al,C为S,
(1)B为Al,B元素在元素周期表中的位置是第三周期 IIIA族,
故答案为:第三周期 IIIA族;
(2)元素金属性越强,非金属性越弱,最高价氧化物对应的水化物酸性越强、碱性越弱,所以A、B、C三种元素最高价氧化物对应的水化物酸性渐强、碱性渐弱的顺序为NaOH、Al(OH)3、H2SO4 ,
故答案为:NaOH、Al(OH)3、H2SO4 ;
(3)A、B两元素的最高价氧化物对应的水化物分别为氢氧化钠与氢氧化铝,反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)在原电池中,Al是活泼金属,做负极,故石墨为正极,Al失电子:Al-3e-=Al3+,
故答案为:正极;Al-3e-=Al3+;
(5)由题意可知SO2的体积为1120m3×2%=22.4m3=22400L
再根据V=n×22.4
所以n=22400÷22.4=1000mol
即有1000mol的SO2,即1000mol的S
即有1000mol的CaSO4•2H2O,
又因为CaSO4•2H2O的摩尔质量M=40+32+16×4+18×2=172g/mol
所以m=n×M=1000×172g=172Kg
答:理论上可以得到172千克石膏.
点评 本题考查原子结构与元素周期表的关系,元素金属性强弱与碱性关系,元素守恒思想,难度适中.

| A. | 最外层有2个电子的元素都是金属元素 | |
| B. | 不管哪一个电子层作为最外层,其电子数都不能超过8个 | |
| C. | 在原子核外的电子层中,电子层大的能量低,电子层小的能量高 | |
| D. | 凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 |
| A. | a>b>c | B. | a>c>b | C. | c>a>b | D. | c>b>a |
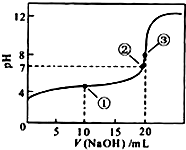 常温下,用0.1000mol•L-1NaOH溶液滴定 20.00mL0.1000mol•L-1CH3COOH溶液所得滴定曲线如图.下列说法正确的是( )
常温下,用0.1000mol•L-1NaOH溶液滴定 20.00mL0.1000mol•L-1CH3COOH溶液所得滴定曲线如图.下列说法正确的是( )| A. | 点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+) | |
| B. | 点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-) | |
| C. | 点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| D. | 滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(Na+)>c(OH-) |
| A. | Si和Na | B. | B和H | C. | Cl和C | D. | C和Al |
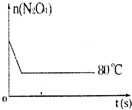 在80℃时,0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中发生如下反应:N2O4?2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
在80℃时,0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中发生如下反应:N2O4?2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:| 时间(s)n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(2)80℃该反应的平衡常数K=1.8mol•L-1.
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色变浅(填“变浅”、“变深”或“不变”).
(4)要增大该反应的K值,可采取的措施有(填序号)D,若要重新达到平衡时,使[NO2]/[N2O4]值变小,可采取的措施有(填序号)AB.
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线.
 ;
;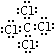 ,分子内含有极性键.
,分子内含有极性键.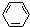 、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.
、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.