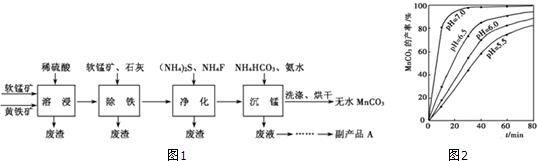
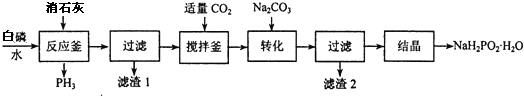
6.类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是( )
| 已知 | 类推 | |
| A | 将Fe加入CuSO4溶液中: Fe+Cu2+═Cu+Fe2+ | 将Na加入到CuSO4溶液中: 2Na+Cu2+═Cu+2Na+ |
| B | 向稀硫酸溶液中加入NaOH溶液至中性:H++OH-═H2O | 向稀H2SO4溶液中加入Ba(OH)2溶液至中性:H++OH-═H2O |
| C | 向有水垢的瓶胆内加入足量稀盐酸溶液: CaCO3+2H+═Ca2++CO2↑+H2O | 向有水垢的瓶胆内加入足量醋酸溶液: CaCO3+2H+═Ca2++CO2↑+H2O |
| D | 向Ca(OH)2溶液中通入过量CO2: CO2+OH-═HCO3- | 向Ca(OH)2溶液中通入过量SO2: SO2+OH-═HSO3- |
| A. | A | B. | B | C. | C | D. | D |
5.下列推断正确的是( )
| A. | SO2、SO3组成元素相同,与H2O反应产物也相同 | |
| B. | 浓硝酸见光会分解,故有时在实验室看到的浓硝酸呈黄色 | |
| C. | CO、NO、NO2都能形成光化学烟雾,是大气污染气体,在空气中都能稳定存在 | |
| D. | 新制氯水显酸性,向新制氯水中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
4.下列Ⅰ、Ⅱ叙述正确并且有因果关系的是( )
| 选项 | Ⅰ | Ⅱ |
| A | SO2有漂白性 | SO2可使溴水褪色 |
| B | SiO2有导电性 | SiO2可用于制备光导纤维 |
| C | Fe3+有氧化性 | 利用30%的FeCl3溶液腐蚀铜箔制造印刷线路板 |
| D | C12有剧毒 | 大量氯气泄漏时,用烧碱溶液浸湿软布蒙面,并迅速离开现场 |
| A. | A | B. | B | C. | C | D. | D |
3.无机非金属材料的品种繁多,用途各异.下列物质中属于无机非金属材料的是( )
①陶瓷,②胆矾,③水泥,④漂白粉,⑤玻璃,⑥晶体硅,⑦液氨.
①陶瓷,②胆矾,③水泥,④漂白粉,⑤玻璃,⑥晶体硅,⑦液氨.
| A. | ①③⑤ | B. | ②④⑥ | C. | ⑤⑦ | D. | ⑥⑦ |
17.对实验过程中出现的异常现象进行探究,是实施素质教育、培养创新精神的有效途经.
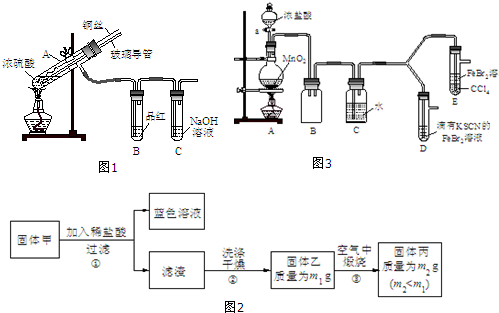
【实验1】用图1实验装置进行铜与浓硫酸的反应,实验中发现试管内除了产生白色硫酸铜固体外,在
铜丝表面还有黑色固体甲生成,甲中可能含有黑色的CuO、CuS、Cu2S.查阅资料:CuS和Cu2S均为黑色固体,常温下都不溶于稀盐酸,在空气中煅烧,均转化为CuO和SO2.为了探究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如图2实验:
(1)上述实验装置除了有尾气吸收装置外,还有一个显著的优点是在熄灭酒精灯后,B中的液体不会倒吸.
(2)固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有泥三角、坩埚(坩埚钳).
(3)确定乙是否煅烧完全的操作是重复操作(再煅烧、冷却、称量),直至恒重(前后两次称量差不超过0.001g).
(4)煅烧过程中一定发生的化学反应方程式为2CuS+3O2$\frac{\underline{\;煅烧\;}}{\;}$2CuO+2SO2.
【实验2】某化学兴趣小组设计了如图3实验装置(尾气吸收装置未画出),探究Cl2、Br2、Fe3+的氧化性强弱.
(5)根据下列实验操作和现象,填写实验结论.
(6)因忙于观察和记录,没有及时停止反应,D、E中均发生了异常的变化:D装置中,红色慢慢褪去;E装置中,CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色.
为探究上述实验现象的本质,小组同学查得资料如下:
①请用平衡移动原理(结合化学用语)解释Cl2过量时D中溶液红色褪去的原因过量氯气和SCN-反应:2SCN-+Cl2=2Cl-+(SCN)2,使SCN-浓度减小,则Fe3++3SCN-?Fe(SCN)3平衡逆向移动而褪色;
请设计简单实验证明上述解释取少量褪色后的溶液,滴加KSCN溶液,若溶液变红色,则上述推测合理,或取少量褪色后的溶液,滴加FeCl3溶液,若溶液不变红,则上述推测合理.
②欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生.请结合化学用语解释仅产生白色沉淀的原因BrCl+H2O=HBrO+HCl反应只产生Cl-,不产生Br-.
0 169754 169762 169768 169772 169778 169780 169784 169790 169792 169798 169804 169808 169810 169814 169820 169822 169828 169832 169834 169838 169840 169844 169846 169848 169849 169850 169852 169853 169854 169856 169858 169862 169864 169868 169870 169874 169880 169882 169888 169892 169894 169898 169904 169910 169912 169918 169922 169924 169930 169934 169940 169948 203614

【实验1】用图1实验装置进行铜与浓硫酸的反应,实验中发现试管内除了产生白色硫酸铜固体外,在
铜丝表面还有黑色固体甲生成,甲中可能含有黑色的CuO、CuS、Cu2S.查阅资料:CuS和Cu2S均为黑色固体,常温下都不溶于稀盐酸,在空气中煅烧,均转化为CuO和SO2.为了探究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如图2实验:
(1)上述实验装置除了有尾气吸收装置外,还有一个显著的优点是在熄灭酒精灯后,B中的液体不会倒吸.
(2)固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有泥三角、坩埚(坩埚钳).
(3)确定乙是否煅烧完全的操作是重复操作(再煅烧、冷却、称量),直至恒重(前后两次称量差不超过0.001g).
(4)煅烧过程中一定发生的化学反应方程式为2CuS+3O2$\frac{\underline{\;煅烧\;}}{\;}$2CuO+2SO2.
【实验2】某化学兴趣小组设计了如图3实验装置(尾气吸收装置未画出),探究Cl2、Br2、Fe3+的氧化性强弱.
(5)根据下列实验操作和现象,填写实验结论.
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯. | D装置中:溶液变红 E装置中:水层溶液变黄,振荡后,CCl4层无明显变化. | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: Cl2>Br2>Fe3+ |
为探究上述实验现象的本质,小组同学查得资料如下:
| ⅰ.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2. ⅱ.Cl2和Br2反应生成的BrCl呈红色,沸点约5℃,与水发生水解反应. ⅲ.AgClO、AgBrO均可溶于水. |
请设计简单实验证明上述解释取少量褪色后的溶液,滴加KSCN溶液,若溶液变红色,则上述推测合理,或取少量褪色后的溶液,滴加FeCl3溶液,若溶液不变红,则上述推测合理.
②欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生.请结合化学用语解释仅产生白色沉淀的原因BrCl+H2O=HBrO+HCl反应只产生Cl-,不产生Br-.