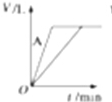
19.把下列四种Na2S2O3溶液分别加入四个盛有10mL 2mol/L硫酸的锥形瓶中,均加水稀释到50mL,其中反应最快的是( )
| A. | 10℃,20mL、3mol/L的Na2S2O3溶液 | B. | 20℃,10mL、4mol/L的Na2S2O3溶液 | ||
| C. | 20℃,30mL、2mol/L的Na2S2O3溶液 | D. | 10℃,10mL、2mol/L的Na2S2O3溶液 |
18.现有部分短周期元素的性质或原子结构如下表:
(1)元素T位于元素周期表的第三周期第ⅥA族.写出T2-的原子结构示意图 .
.
(2)元素Y氢元素形成一种离子YH4+,写出该微粒发生水解反应的离子方程式NH4++H2O?NH3.H2O+H+.
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b.
a 常温下Z的单质和T的单质状态不同
b Z的氢化物比T的氢化物稳定
c 一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是H2CO3(填化学式).
| 元素编号 | 元素性质或原子结构 |
| T | M层电子数比K层电子数多4个 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
 .
.(2)元素Y氢元素形成一种离子YH4+,写出该微粒发生水解反应的离子方程式NH4++H2O?NH3.H2O+H+.
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b.
a 常温下Z的单质和T的单质状态不同
b Z的氢化物比T的氢化物稳定
c 一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是H2CO3(填化学式).
14. 实验题
实验题
(1)合理选择饮食和良好生活方式,是健康的重要保证,这些都离不开化学知识.
某同学位探究蔗糖的水解反应,进行如下实验:
(2)“酒是陈的香”的原因之一是储存过程中生成了有香味的酯.实验室用如图所示装置制取乙酸乙酯.
①试管a中生成乙酸乙酯的化学反应方程式是CH3COOH+CH3CH2OH CH3COOC2H5+H2O.
CH3COOC2H5+H2O.
②试管b中盛放的试剂是饱和碳酸钠溶液,试管b中的导管不伸入液面下的原因是防止倒吸.试管b中发生反应的化学方程式是2CH3COOH+Na2CO3=2CH3COONa+H2O+CO2↑.
③生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态.下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)②④⑤.
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化.
 实验题
实验题(1)合理选择饮食和良好生活方式,是健康的重要保证,这些都离不开化学知识.
某同学位探究蔗糖的水解反应,进行如下实验:
| 实验步骤 | 实验现象 |
| I.向编号为①②③的3支试管中,分别加入1mL 20%的蔗糖溶液,向试管②和③中加入0.5mL稀硫酸,并将这3支试管同时水浴加热约5min | 均无明显现象 |
| II.取试管①和②,加入新制氢氧化铜悬浊液,加热至沸腾 | 未见砖红色沉淀 |
| Ⅲ.取试管③,先加入NaOH溶液(或其它碱性溶液)调溶液pH至碱性,再加入新制氢氧化铜悬浊液,加热至沸腾 | 试管③中观察到产生砖红色沉淀 |
| 结论:证明蔗糖在稀硫酸作用下发生了水解反应. | |
①试管a中生成乙酸乙酯的化学反应方程式是CH3COOH+CH3CH2OH
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.②试管b中盛放的试剂是饱和碳酸钠溶液,试管b中的导管不伸入液面下的原因是防止倒吸.试管b中发生反应的化学方程式是2CH3COOH+Na2CO3=2CH3COONa+H2O+CO2↑.
③生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态.下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)②④⑤.
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化.
13.Na2S溶液中存在多种微粒,下列各微粒间的关系正确的是( )
| A. | c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) | B. | c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) | ||
| C. | c(Na+)=c(HS-)+2c(H2S)+2c(S2-) | D. | c(OH-)=c(H+)+c(HS-)+2c(H2S) |
12.下列四种元素中,其单质氧化性最强的是( )
| A. | 基态原子含有未成对电子最多的第二周期元素 | |
| B. | 基态原子电子排布式为[Ne]3s23p1的元素 | |
| C. | 基态原子最外电子层排布为2s22p6的元素 | |
| D. | 基态原子最外电子层排布为3s23p5的元素 |
11.同一周期的4种元素,原子半径从小到大的顺序为C<A<D<B(不包括稀有气体元素),则最有可能形成共价化合物的是( )
| A. | C与A | B. | C与D | C. | D与B | D. | B与C |
10.下列烷烃的命名正确的是( )
0 169695 169703 169709 169713 169719 169721 169725 169731 169733 169739 169745 169749 169751 169755 169761 169763 169769 169773 169775 169779 169781 169785 169787 169789 169790 169791 169793 169794 169795 169797 169799 169803 169805 169809 169811 169815 169821 169823 169829 169833 169835 169839 169845 169851 169853 169859 169863 169865 169871 169875 169881 169889 203614
| A. | 2,4-二乙基戊烷 | B. | 2,3,3-三甲基戊烷 | ||
| C. | 2-甲基-3-丙基戊烷 | D. | 4-甲基-2-乙基已烷 |


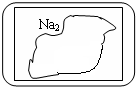 现有一盛有无色固体物质M的试剂瓶,标签已破损(见图).
现有一盛有无色固体物质M的试剂瓶,标签已破损(见图).