题目内容
15.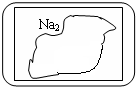 现有一盛有无色固体物质M的试剂瓶,标签已破损(见图).
现有一盛有无色固体物质M的试剂瓶,标签已破损(见图).(1)若M的水溶液为中性,则实验室检验M中阴离子的离子方程式为Ba2++SO42-=BaSO4↓.
(2)若M的水溶液呈碱性,加入过量盐酸后产生无色无味的气体,则M的俗名叫纯碱.
(3)若M置于空气中易被氧化为另一种物质,生成物的摩尔质量比M增加了16,则M的化学式为Na2SO3.
(4)若M的水溶液呈碱性,加入过量盐酸后产生臭鸡蛋气味的气体,则M与盐酸反应后生成的气体在过量空气中燃烧的化学方程式为2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O.
分析 根据符合图示内容的物质可以是硫酸钠,碳酸钠、过氧化钠、硫化钠、亚硫酸钠等这些物质,
(1)M的水溶液为中性,则M为强酸的钠盐Na2SO4,检验其中硫酸根离子,可以根据硫酸根离子和钡离子之间反应得到白色不溶于硝酸的沉淀来检验;
(2)若M水溶液呈碱性,则为强碱弱酸盐,加入过量盐酸后产生无色无味的气体,该气体为二氧化碳,则M为Na2CO3,碳酸钠的俗名为纯碱;
(3)若物质M置于空气中易被氧化为另一种物质,M中具有还原性的离子,生成物的摩尔质量比M增加了16,即多了一个氧原子,则Na2SO3;
(4)若其水溶液呈碱性,则为强碱弱酸盐,加入过量盐酸后产生腐卵臭气味的气体即硫化氢,所以M是Na2S,M与盐酸反应后生成的气体是H2S,写出硫化氢气体在过量空气中燃烧的化学方程式.
解答 解:由存在的化学式部分可知酸根的化合价是-2价,化合价为-2价的酸根有硫酸根、碳酸根、亚硫酸根离子等,
(1)若M的水溶液为中性,则为强酸的钠盐,即为Na2SO4,检验其中硫酸根离子,可以根据硫酸根离子和钡离子之间反应得到白色不溶于硝酸的沉淀来检验,即离子方程式为Ba2++SO42-=BaSO4↓,
故答案为:Ba2++SO42-=BaSO4↓;
(2)若其水溶液呈碱性,则为强碱弱酸盐,加入过量盐酸后产生无色无味的气体,即M为Na2CO3,碳酸钠的俗名为纯碱,
故答案为:纯碱;
(3)若物质M置于空气中易被氧化为另一种物质,M中具有还原性的离子,生成物的摩尔质量比M增加了16,即多了一个氧原子,所以是Na2SO3,故答案为:Na2SO3;
(4)若其水溶液呈碱性,则为强碱弱酸盐,加入过量盐酸后产生腐卵臭气味的气体即硫化氢,所以M是Na2S,M与盐酸反应后生成的气体是H2S,硫化氢气体在过量空气中燃烧的化学方程式为:2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O,
故答案为:2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O.
点评 本题考查了未知物的检验,题目难度不大,明确常见元素单质及其化合物性质及检验方法为解答关键,试题侧重考查学生的分析能力及灵活应用基础知识的能力.

| A. | 稀硫酸加入氢氧化钡溶液中:H++OH-═H2O | |
| B. | 铜片上滴加稀硝酸:3Cu+8H++2 NO3-═3Cu2++2NO↑+4H2O | |
| C. | 石灰石投入到稀醋酸中:CO32-+2 H+═CO2↑+H2O | |
| D. | Fe粉加入稀盐酸中:Fe+2H+═Fe2++H2↑ |
| A. | 甲醛 | B. | 甲酸 | C. | 甲醇 | D. | 甲苯 |
| A. | 金属腐蚀就是金属原子失去电子被还原的过程 | |
| B. | 镀锌铁皮的镀层损坏后,铁还是受到保护而难以腐蚀 | |
| C. | 钢铁的腐蚀通常有吸氧腐蚀和析氢腐蚀,通常情况下以吸氧腐蚀为主 | |
| D. | 氯碱工业中,阳极发生的反应为:2H++2e-═H2↑ |
| A. | 2,4-二乙基戊烷 | B. | 2,3,3-三甲基戊烷 | ||
| C. | 2-甲基-3-丙基戊烷 | D. | 4-甲基-2-乙基已烷 |
| A. | 2.4g镁在二氧化碳中燃烧所转移的电子总数为0.2NA | |
| B. | 7.1g Cl2与足量NaOH(aq)反应时转移的电子总数为0.2 NA | |
| C. | 1 L1 mol/L的Na2CO3(aq)中CO32-与HCO3-的离子数之和为NA | |
| D. | 1 mol NaHSO4晶体中离子总数为3NA |
| A. | 1和17 | B. | 15和8 | C. | 14和 6 | D. | 12和9 |
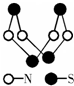
| A. | 该物质的分子式为SN | |
| B. | 该物质的分子中只有极性键,没有非极性键 | |
| C. | 该物质分子中N-S键键能很大,故其晶体有很大的硬度 | |
| D. | 该物质与化合物S2N2互为同素异形体 |
| A. | CH3COOH | B. | H2 | C. | HCOOH | D. | CO |