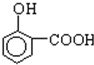
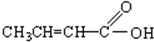题目内容
17.将等质量的A、B两份锌粉分别装入两支试管中,并都加入过量的稀硫酸,同时向装A的试管中加入少量CuSO4溶液.如图表示产生氢气的体积V与时间t的关系,其中正确的是( )| A. | 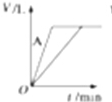 | B. |  | C. | 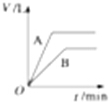 | D. |  |
分析 锌和硫酸反应,加入硫酸铜,会置换出金属铜,形成锌、铜、稀硫酸原电池,加速金属锌和硫酸反应的速率,产生氢气的量取决于金属锌的质量.
解答 解:锌和硫酸反应,加入硫酸铜,会置换出金属铜,形成锌、铜、稀硫酸原电池,加速金属铁和硫酸反应的速率,所以反应速率是:A>B,速率越大,锌完全反应时所用的时间越短,所以A所用的时间小于B的时间;产生氢气的量取决于金属锌的质量,而A中,金属锌一部分用于置换金属铜,导致和硫酸反应生成氢气的量减少,所以氢气的体积是:A<B.
故选D.
点评 本题考查了根据图象判断反应速率的大小,难度不大,分析图象时注意图象中坐标的含义、拐点变化趋势来解答.

练习册系列答案
相关题目
8.下列有关蛋白质的叙述中,不正确的是( )
| A. | 蛋白质溶液加入饱和(NH4)2SO4溶液,蛋白质析出,再加入水不溶解 | |
| B. | 人工合成的具有生命活性的蛋白质---结晶牛胰岛素,是我国科学家在世界上第一次合成的 | |
| C. | 蚕丝、动物毛发、皮革制品等生活常见物品主要成分均为蛋白质 | |
| D. | 浓HNO3溅在皮肤上,使皮肤呈黄色,是由于浓HNO3和蛋白质发生颜色反应 |
5.定量分析中可用AgNO3溶液滴定Cl-溶液,加入K2CrO4为指示剂,达到滴定终点时溶液体积为50mL,c(Cl-)=10-5 mol•L-1,AgNO3与CrO42-生成砖红色的Ag2CrO4沉淀.已知Ksp(AgCl)=1.77×10-10,Ksp(AgI)=8.51×10-17,Ksp(Ag2CrO4)=1.12×10-12,根据以上实验操作和有关数据,下列说法正确的是( )
| A. | 常温下,向含AgCl固体的AgCl溶液中加入NaCl固体,AgCl沉淀的量不变 | |
| B. | 滴定终点时,溶液中CrO42-的浓度约为3.6×10-3 mol•L-1 | |
| C. | 向0.1moL/L AgNO3溶液中滴加3-5滴0.1moL/L NaCl溶液生成AgCl沉淀,再滴加KI溶液,生成AgI沉淀,能够说明Ksp(AgI)<Ksp(AgCl) | |
| D. | 可用0.1 mol•L-1的KI溶液代替K2CrO4做指示剂 |
12.下列四种元素中,其单质氧化性最强的是( )
| A. | 基态原子含有未成对电子最多的第二周期元素 | |
| B. | 基态原子电子排布式为[Ne]3s23p1的元素 | |
| C. | 基态原子最外电子层排布为2s22p6的元素 | |
| D. | 基态原子最外电子层排布为3s23p5的元素 |
2.下列有机物中,完全燃烧时生成的二氧化碳与水的物质的量之比为2:1的是( )
| A. | 乙烷 | B. | 乙烯 | C. | 乙炔 | D. | 乙醇 |
9.实验室制备氯气的装置如图.图中涉及气体发生、除杂、干燥、收集、尾气处理装置,其中错误的是( )


| A. | ① | B. | ② | C. | ③ | D. | ④ |
6.据报道,已发现了第114号元素.下列关于其推测不正确的是( )
| A. | 它有+2,+3,+4价 | B. | 其晶体有良好的导电性 | ||
| C. | 其原子最外层上有4个电子 | D. | 该元素位于第七周期ⅣA族 |
7.下列有关同分异构体数目的叙述中,正确的是( )
| A. | 甲苯苯环上的一个氢原子被含4个碳原子的烷基取代,所得产物有12种 | |
| B. | 等物质的量的氯气与乙烷在光照条件下反应得到9种产物 | |
| C. | 已知二氯苯有3种同分异构体,则四氯苯的同分异构体的数目为6种 | |
| D. | 苯乙烯和氢气完全加成的产物的一溴取代物有5种 |