题目内容
11.同一周期的4种元素,原子半径从小到大的顺序为C<A<D<B(不包括稀有气体元素),则最有可能形成共价化合物的是( )| A. | C与A | B. | C与D | C. | D与B | D. | B与C |
分析 同周期从左到右原子半径逐渐减小,非金属性逐渐增强,所以C和A非金属性强,而活泼的金属与非金属之间易形成离子键,非金属与非金属之间易形成共价键,由此分析解答.
解答 解:同周期从左到右原子半径逐渐减小,非金属性逐渐增强,所以C和A非金属性强,则C与A之间易形成共价化合物,故选A.
点评 本题考查原子结构和元素周期律的关系,明确元素的非金属性为解答该题的关键,把握元素周期律的递变规律,题目难度不大.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案
相关题目
1.下列说法正确的是( )
| A. | 充电电池可无限制地反复充放电 | |
| B. | 电能是一次能源 | |
| C. | 通过化学反应可实现能量间的相互转化 | |
| D. | 燃料电池的能量转化率可达100% |
19.下列化学用语书写正确的是( )
| A. | Cl一的结构示意图: | B. | CH4分子的球棍模型: | ||
| C. | 氯化镁的电子式: | D. | 8个中子的碳原子的核素符号:12C |
6.下列混合溶液中,各离子浓度的大小顺序不正确的是( )
| A. | 物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+c(CH3COOH)=2c(Na+) | |
| B. | 物质的量浓度相等Na2CO3和NaHCO3溶液等体积混合:离子浓度的大小顺序是:c (Na+)>c (HCO3-)>c(CO32-)>c(OH-)>c(H+) | |
| C. | CH3COONa溶液中c(OH-)=c(CH3COOH)+c(H+) | |
| D. | 1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
3.下列能说明乙醇分子中有一个氢原子与其他氢原子不同的是( )
| A. | 乙醇能燃烧 | |
| B. | 1molCH3CH2OH与Na完全反应只生成0.5molH2 | |
| C. | 乙醇分子中含有一个氧原子 | |
| D. | 乙醇能溶于水 |
20.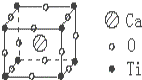 已知某化合物是由钙、钛、氧三种元素组成的晶体,其晶胞结构如图所示,则该物质的化学式为( )
已知某化合物是由钙、钛、氧三种元素组成的晶体,其晶胞结构如图所示,则该物质的化学式为( )
 已知某化合物是由钙、钛、氧三种元素组成的晶体,其晶胞结构如图所示,则该物质的化学式为( )
已知某化合物是由钙、钛、氧三种元素组成的晶体,其晶胞结构如图所示,则该物质的化学式为( )| A. | CaTiO3 | B. | CaTiO6 | C. | Ca4TiO3 | D. | CaTiO12 |
1.下列有关化学键和化合物的说法不正确的是( )
| A. | 离子键就是阴阳离子间强烈的静电作用 | |
| B. | H和Cl形成的分子中存在的是极性共价键 | |
| C. | 氯化铵中没有金属元素,所以不是离子化合物 | |
| D. | 11号与9号元素能够形成离子化合物,该化合物中存在离子键 |
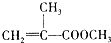 )是有机玻璃的单体,其分子在核磁共振氢谱图中能显示3个不同的峰.下列物质属于甲基丙烯酸甲酯同分异构体的是①④(填选项序号)
)是有机玻璃的单体,其分子在核磁共振氢谱图中能显示3个不同的峰.下列物质属于甲基丙烯酸甲酯同分异构体的是①④(填选项序号)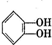 ④
④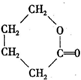
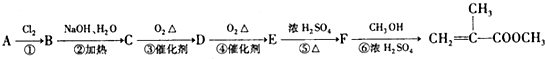
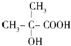 .
.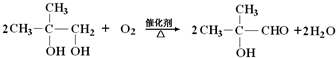 ;
; .
.