6.铅酸蓄电池是目前应用普遍的化学电池,新型液流式铅酸蓄电池以可溶的甲基磺酸铅为电解质,电池总反应:Pb+PbO2+4H+$?_{充电}^{放电}$2Pb2++2H2O.下列有关新型液流式铅酸蓄电池的说法正确的是( )
| A. | 充放电时,溶液中Pb2+浓度保持不变 | |
| B. | 放电时转移2mol电子,消耗2molPb | |
| C. | 放电时的负极反应式为:Pb-2e-═Pb2+ | |
| D. | 充电时的阳极反应式为:Pb2++4OH+2e-═PbO2+2HO |
5.短周期主族元素A、B、C、D、E的原子序数依次递增,A、B两元素相邻,B、C、E原子的最外层电子数之和为13,E原子最外层电子数是B原子内层电子数的3倍或者C原子最外层电子数的3倍,B、D原子最外层电子数之和等于C、E原子最外层电子数之和.下列说法正确的是( )
| A. | 元素B和E的最高价氧化物对应的水化物均为强酸 | |
| B. | A、B的气态氢化物的稳定性:A>B | |
| C. | 元素C、D、E的最高价氧化物对应的水化物之间均可相互反应 | |
| D. | 工业上常用电解元素C、D的氯化物来制取它们的单质 |
4.Al、Fe、Cu都是重要的金属元素.下列说法正确的是( )
| A. | 三种元素对应的氧化物均为碱性氧化物 | |
| B. | 三者的单质长期放置在空气中均能被腐蚀 | |
| C. | 制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 | |
| D. | 电解AlCl3、FeCl3、CuCl2的混合溶液时,阴极上依次析出Cu、Fe、Al |
3.下列有关物质的性质或应用说法正确的是( )
| A. | 碳酸钠用于治疗胃溃疡病人的胃酸过多症 | |
| B. | 金属钠具有强的还原性,可利用钠和TiCl4溶液反应制取金属Ti | |
| C. | 糖类、油脂、蛋白质在一定条件下均可以水解 | |
| D. | 硅酸钠水溶液呈碱性,可以用来制硅酸 |
2.下列离子方程式正确的是( )
| A. | 淀粉碘化钾溶液在空气中变蓝:4I+O2+2H2O═4OH-+2I2 | |
| B. | 用NaOH溶液吸收氯气:2OH-+2Cl2═2Cl-+H2O | |
| C. | 少量CO2通入苯酚钠溶液中:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| D. | 氯化镁溶液与氨水反应:Mg2++2OH-═Mg(OH)2↓ |
1.下列说法中正确的是( )
| A. | 将纯水加热至较高温度,水的离子积变大,pH减小,呈酸性 | |
| B. | 碱性氢氧燃料电池工作时,OH-向正极迁移 | |
| C. | 反应2A(g)+B(g)═3C(s)+D(g)在一定条件下能自发进行,说明该反应的△H>0 | |
| D. | 用饱和Na2CO3溶液处理BaSO4沉淀,可将BaSO4转化为BaCO3 |
20.下列有关实验原理、方法和结论都正确的是( )
| A. | 向某溶液中加入盐酸酸化的氯化钡溶液有白色沉淀生成,该溶液中一定含SO42- | |
| B. | 向蛋白质溶液中加入硫酸铜溶液,将得到的沉淀分离出来,再加水可重新溶解 | |
| C. | 除去苯中含有的苯酚,可先加NaOH溶液,充分反应后静置分液 | |
| D. | 淀粉和稀硫酸混合加热一段时间后,加入氢氧化钠使溶液呈碱性,再加入新制Cu(OH)2后加热,若有砖红色沉淀生成,则淀粉已经完全水解 |
19.依据题目要求回答下列问题.
(1)常温下,浓度均为 0.l mol•L-1的下列六种溶液的pH如下表:
①上述盐溶液中的阴离子,结合H+ 能力最强的是CO32-.
②浓度均为0.0l mol•L-1的下列五种物质的溶液中,酸性最强的是D(填编号);将各溶液分别稀释100倍,pH变化最小的是C(填编号)
A.HCN B.HClO C.C6H5OH D.CH3COOH E.H2CO3
③据上表数据,请你判断下列反应不能成立的是D(填编号)
A.CH3COOH+Na2CO3═NaHCO3+CH3COONa
B.CH3COOH+NaCN═CH3COONa+HCN
C.CO2+H2O+NaClO═NaHCO3+HClO
D.CO2+H2O+2C6H5ONa═Na2CO3+2C6H5OH
④要增大氯水中HC1O的浓度,可向氯水中加入少量的碳酸氢钠溶液,反应的离子方程式为Cl2+HCO3-+H2O=CO2↑+Cl-+HClO.
(2)已知常温下Cu(OH)2的Ksp=2×10-20.又知常温下某CuSO4溶液里 c(Cu2+)=0.02mol•L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于5.
(1)常温下,浓度均为 0.l mol•L-1的下列六种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
②浓度均为0.0l mol•L-1的下列五种物质的溶液中,酸性最强的是D(填编号);将各溶液分别稀释100倍,pH变化最小的是C(填编号)
A.HCN B.HClO C.C6H5OH D.CH3COOH E.H2CO3
③据上表数据,请你判断下列反应不能成立的是D(填编号)
A.CH3COOH+Na2CO3═NaHCO3+CH3COONa
B.CH3COOH+NaCN═CH3COONa+HCN
C.CO2+H2O+NaClO═NaHCO3+HClO
D.CO2+H2O+2C6H5ONa═Na2CO3+2C6H5OH
④要增大氯水中HC1O的浓度,可向氯水中加入少量的碳酸氢钠溶液,反应的离子方程式为Cl2+HCO3-+H2O=CO2↑+Cl-+HClO.
(2)已知常温下Cu(OH)2的Ksp=2×10-20.又知常温下某CuSO4溶液里 c(Cu2+)=0.02mol•L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于5.
18.决定化学反应速率的主要因素是( )
0 169669 169677 169683 169687 169693 169695 169699 169705 169707 169713 169719 169723 169725 169729 169735 169737 169743 169747 169749 169753 169755 169759 169761 169763 169764 169765 169767 169768 169769 169771 169773 169777 169779 169783 169785 169789 169795 169797 169803 169807 169809 169813 169819 169825 169827 169833 169837 169839 169845 169849 169855 169863 203614
| A. | 反应物的浓度 | B. | 温度、压强以及反应物的接触面积 | ||
| C. | 催化剂 | D. | 参加反应的物质本身的性质 |
 .
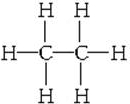
.
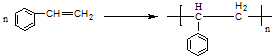 .
.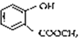 含有的官能团的名称为酚羟基、酯基.
含有的官能团的名称为酚羟基、酯基.