15.下列物质中,既含有离子键,又含有非极性共价键的是( )
| A. | H2O | B. | CaCl2 | C. | NH4Cl | D. | Na2O2 |
14.最近,意大利科学家使用普通氧分子和带正电荷的氧离子制造出了4个氧原子构成的氧分子O4,并用质谱仪器探测到了它是一种存在时间很短的化学物质.该氧分子具有空间对称结构,下列关于该氧分子的说法正确的是( )
| A. | 是一种新的化合物 | B. | 可能含有极性键 | ||
| C. | 与O2都是由氧元素构成的单质 | D. | 在自然界中能稳定存在 |
13. 英国科学家近日研发出一种名为NOTT-202a的新型多孔材料,空气中其他气体可自由通过这些空洞,但CO2会被截留.该材料的分子结构单元是以铟原子为中心,周围是以各种有机分子链条编织的“笼子”,整体上看呈现多孔特征,有些类似自然界中的蜂窝结构,下列有关说法正确的是( )
英国科学家近日研发出一种名为NOTT-202a的新型多孔材料,空气中其他气体可自由通过这些空洞,但CO2会被截留.该材料的分子结构单元是以铟原子为中心,周围是以各种有机分子链条编织的“笼子”,整体上看呈现多孔特征,有些类似自然界中的蜂窝结构,下列有关说法正确的是( )
0 169564 169572 169578 169582 169588 169590 169594 169600 169602 169608 169614 169618 169620 169624 169630 169632 169638 169642 169644 169648 169650 169654 169656 169658 169659 169660 169662 169663 169664 169666 169668 169672 169674 169678 169680 169684 169690 169692 169698 169702 169704 169708 169714 169720 169722 169728 169732 169734 169740 169744 169750 169758 203614
 英国科学家近日研发出一种名为NOTT-202a的新型多孔材料,空气中其他气体可自由通过这些空洞,但CO2会被截留.该材料的分子结构单元是以铟原子为中心,周围是以各种有机分子链条编织的“笼子”,整体上看呈现多孔特征,有些类似自然界中的蜂窝结构,下列有关说法正确的是( )
英国科学家近日研发出一种名为NOTT-202a的新型多孔材料,空气中其他气体可自由通过这些空洞,但CO2会被截留.该材料的分子结构单元是以铟原子为中心,周围是以各种有机分子链条编织的“笼子”,整体上看呈现多孔特征,有些类似自然界中的蜂窝结构,下列有关说法正确的是( )| A. | 该材料完全由金属元素构成 | |
| B. | 该材料能捕集CO2,是因为该材料可以选择性吸收CO2 | |
| C. | 该材料捕集11.2LCO2后,增重22g | |
| D. | 可利用该材料将空气中的CO2,完全捕集,从而控制温室效应 |




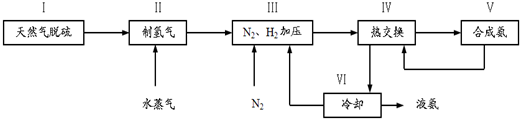
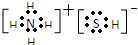 ,写出再生反应的化学方程式:2NH4HS+O2=2S↓+2NH3•H2O.NH3的沸点高于H2S,是因为NH3分子之间存在着一种比分子间作用力更强的作用力.
,写出再生反应的化学方程式:2NH4HS+O2=2S↓+2NH3•H2O.NH3的沸点高于H2S,是因为NH3分子之间存在着一种比分子间作用力更强的作用力.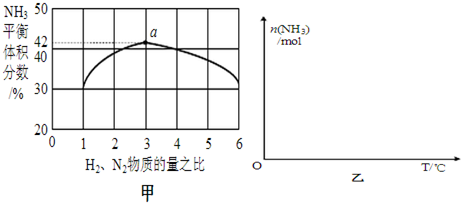

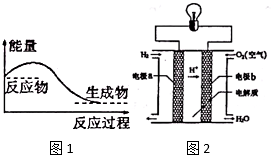 能盘是一个世界性的话题,如何充分利用能量、开发新能源,为人类服务是广大科技工作者不懈努力的目标.
能盘是一个世界性的话题,如何充分利用能量、开发新能源,为人类服务是广大科技工作者不懈努力的目标. .
.
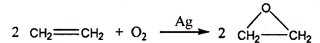

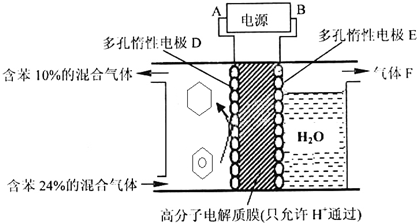
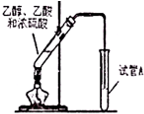 “酒是陈的香”,其原因之一是酒在储存过程中生成了具有香味的乙酸乙酯,在实验室我们也可以用如图所示的装罝制取乙酸乙酯.
“酒是陈的香”,其原因之一是酒在储存过程中生成了具有香味的乙酸乙酯,在实验室我们也可以用如图所示的装罝制取乙酸乙酯. CH3COOC2H5+H2O.
CH3COOC2H5+H2O. 现有X、Y、Z、R、T五种短周期主族元素,R原子电子数是电子层数的3倍:Y与X能形成X2Y、X2Y2型共价化合物,Z与T形成的Z2T型离子化合物.五种元素的原子半径与原子序数的关系如图所示.回答下列问题:
现有X、Y、Z、R、T五种短周期主族元素,R原子电子数是电子层数的3倍:Y与X能形成X2Y、X2Y2型共价化合物,Z与T形成的Z2T型离子化合物.五种元素的原子半径与原子序数的关系如图所示.回答下列问题: .
.