题目内容
9. 能盘是一个世界性的话题,如何充分利用能量、开发新能源,为人类服务是广大科技工作者不懈努力的目标.
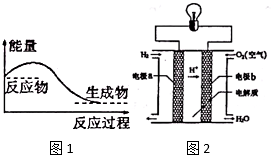
能盘是一个世界性的话题,如何充分利用能量、开发新能源,为人类服务是广大科技工作者不懈努力的目标.(1)哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖.工业上氮气与氢气合成氨反应方程式为:N2+3H2?2NH3,反应过程中的能量变化如图1:由此说明,该反应是放热反应(填“吸热”或“放热”).
(2)①沼气是一种廉价能源,农村存在大量的秸秆、杂草等废弃物,它们经微生物发酵之后,便可产生沼气,可用来点火做饭,已知O.5molCH4完全燃烧生成C02气体和液态水时,放出445kJ热量,则热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.0kJ/mol.
②己知某种煤气的主要成分为CO、H2,现把一套以煤气为燃料的灶具改为以天然气为燃料的灶具时,灶具作相应的调整,正确的方法是B.
A.空气和天然气的进入量都减少 B.增大空气的进入量或减小天然气的进入量
C.空气和天然气的进入量都增加 D.减小空气的进入量或增大天然气的进入量
(3)原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献,①现有如下两个反应:A、NaOH+HCl═NaCl+H20; B、Fe+H2SO4═FeS04+H2↑,能设计成原电池的是B(填编号).
②氢气直接燃烧能量的利用率只能达到30%左右,氢氧燃料电池能量转换率可超过80%.氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图2.写出该氢斌燃料电池的总反应方程式2H2+O2═2H2O.
(4)氢气被人们看做理想的“绿色能源”.下列制氢方法最节能的是C.
A、电解水制氢:2H20$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑
B、髙温使水分解制氢:2H20$\frac{\underline{\;高温\;}}{\;}$2H2↑+O2↑
C、太阳光催化分解水制氢:2H20$\frac{\underline{\;\;\;TiO_{2}\;\;\;}}{太阳光}$2H2↑+O2↑
D、天然气制氢:CH4+H2O$\stackrel{高温}{?}$CO+3H2.
分析 (1)根据反应物总能量和生成总能量可判断反应的热效应;
(2)①O.5molCH4完全燃烧生成C02气体和液态水时,放出445kJ热量,所以1mol甲烷烷醛燃烧生成二氧化碳和液态水放热890.0kJ,据此写出热化学方程式;
②等体积的煤气和天然气相比,燃烧时天然气消耗的氧气多;
(3)①自发的氧化还原反应才能设计成原电池;
②燃氢氧燃料电池反应式就是氢气燃烧方程式;
(4)最节能的方法是运用太阳能.
解答 解:(1)由图可知该反应中反应物总能量高于生成总能量,所以该反应为放热反应,
故答案为:放热;
(2)①O.5molCH4完全燃烧生成C02气体和液态水时,放出445kJ热量,所以1mol甲烷烷醛燃烧生成二氧化碳和液态水放热890.0kJ,甲烷燃烧的热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.0kJ/mol;
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.0kJ/mol;
②等体积的煤气和天然气相比,燃烧时天然气消耗的氧气多,所以把一套以煤气(主要成分是CO、H2)为燃料的灶具改为以天然气为燃料的灶具时,灶具应作相应调整为增大空气的进入量或减小天然气的进入量;
故答案为:B;
(3)①反应A.NaOH+HCl=NaCl+H2O不是氧化还原反应,不能设计成原电池,反应B.Fe+H2SO4═FeS04+H2↑是氧化还原反应,能设计成原电池,
故答案为:B;
②氢氧燃料电池反应式就是氢气燃烧方程式,则电池反应式为2H2+O2═2H2O,
故答案为:2H2+O2═2H2O;
(4)最节能的方法是运用太阳能,高温、电解都需要其它自然资源,故选C.
点评 本题主要考查了反应中的热量变化、热化学方程式、原电池原理、能量的综合利用等,难度中等,答题时注意基础知识的综合应用.

| A. | 它不能燃烧 | |
| B. | 它能使酸性高锰酸钾溶液褪色 | |
| C. | 它是一种高分子纯净物 | |
| D. | 它的单体与家用保鲜膜塑料的单体相同 |
| 烯类化合物 | 相对速率 |
| (CH3)2C=CHCH3 | 10.4 |
| CH3CH=CH2 | 2.03 |
| CH2=CH2 | 1.00 |
| CH2=CHBr | 0.04 |
(2)下列化合物与氯化氢加成时,取代基对速率的影响与上述规律类似,其中反应速率最慢的是D(填代号).
A.(CH3)2C=C(CH3)2 B.CH3CH=CHCH3 C.CH2=CH2 D.CH2=CHCl
(3)已知化合物A与化合物B 的转化关系如下,且化合物B中仅有4个碳原子、1个溴原子、1种氢原子
A$\stackrel{Br_{2}、光照}{→}$B则A的名称为异丁烷,B的结构简式为
 ;该反应的反应类型是取代反应.
;该反应的反应类型是取代反应. | A. | 牛油、纤维素和蛋白质都是天然高分子化合物 | |
| B. | 淀粉属于糖类 | |
| C. | 石油、植物油都只含有C、H两种元素 | |
| D. | 蛋白质遇硫酸铜溶液后产生的沉淀能重新溶于水 |
| A. | 是一种新的化合物 | B. | 可能含有极性键 | ||
| C. | 与O2都是由氧元素构成的单质 | D. | 在自然界中能稳定存在 |
| A. | NaOH溶液 | B. | 新制的Cu(OH)2悬浊液 | ||
| C. | 碘水 | D. | 溴水 |

| A. | 1mol该物质最多可与2molH2发生加成反应 | |
| B. | 该物质的分子式为C9H8O | |
| C. | 加热时,该物质能与新制Cu(OH)2悬浊液反应 | |
| D. | 该物质既能发生加成反应,也能发生取代反应 |
| A. | 金在高温下发生了钝化 | B. | 金越炼硬度越大 | ||
| C. | 金的化学性质稳定,不易变质 | D. | 金的硬度大,高温下难于变形 |
