题目内容
14.最近,意大利科学家使用普通氧分子和带正电荷的氧离子制造出了4个氧原子构成的氧分子O4,并用质谱仪器探测到了它是一种存在时间很短的化学物质.该氧分子具有空间对称结构,下列关于该氧分子的说法正确的是( )| A. | 是一种新的化合物 | B. | 可能含有极性键 | ||
| C. | 与O2都是由氧元素构成的单质 | D. | 在自然界中能稳定存在 |
分析 A.由同种元素组成的纯净物为单质,由不同种元素组成的纯净物为化合物;
B.不同非金属元素的原子形成极性键,同种非金属元素的原子之间形成非极性键;
C.由同种元素组成的纯净物为单质;
D.根据题干信息意大利科学家使用普通氧分子和带正电荷的氧离子制造出了4个氧原子构成的氧分子O4分析.
解答 解:A.4个氧原子构成的氧分子,即O4是同一元素组成的物质,所以是单质,故A错误;
B.有四个原子组成的物质,所以里面含有非极性键,极性键必须是不同元素的原子形成的,故B错误;
C.O4是四个原子构成的分子,与O2都是由氧元素构成的单质,故C正确;
D.O4是制造出来的单质,在自然界中不能稳定存在,故D错误;
故选C.
点评 本题考查了O4有关的知识,掌握单质、极性键同素异形体等知识是解答关键,重点是理解极性键和非极性键的区别,极性键是不同种元素原子形成的,而非极性键必须是同种元素的原子形成的,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.下列各实验操作以及目的都正确的是( )
| A. | 为减缓反应速率,将饱和食盐水滴加到烧瓶中的电石上来制取乙炔 | |
| B. | 实验室制乙烯时应将无水乙醇缓慢加入到浓硫酸中,并加入碎瓷片以防暴沸 | |
| C. | 将浓氨水逐滴加入到2%的硝酸银溶液中至产生的沉淀恰好溶解即制得银氨溶液 | |
| D. | 苯甲酸的重结晶实验中,粗苯甲酸全溶后再加入少量蒸馏水,目的是有利于趁热过滤 |
5.在常温下,用pH=11的某碱溶液分别与pH均为3的醋酸溶液和盐酸等体积混合,得到a、b两种溶液,关于这两种溶液的酸碱性的叙述正确的是( )
| A. | a不可能显中性 | B. | a只能显碱性 | C. | b不可能显酸性 | D. | b只能显中性 |
2.NaH是一种离子化合物,跟水反应的化学方程式为:NaH+H2O═NaOH+H2↑,现有a mol NaH与b mol Al粉混合物跟足量的水反应(a<b),在标准状况下可收集到氢气的量为( )
| A. | 56a L | B. | (a+b)mol | C. | 56b L | D. | (a+b)mol |
19.下列物质一定互为同系物的是( )
| A. | C2H4和C3H6 | B. | C2H6和C9H20 | C. | 乙醇和乙酸 | D. | 葡萄糖和果糖 |
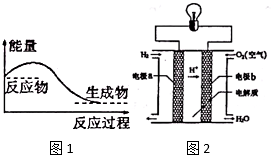
6.如图是课外活动小组设计的用化学电源使LED灯发光的装置,下列说法正确的是( )


| A. | 铜片表面有气泡生成 | |
| B. | 该装置能使化学能直接转变为光能 | |
| C. | 如果将硫酸换成CuSO4溶液,导线中不会有电子流动 | |
| D. | 电路中电子的流动方向是Cu→Zn |
3.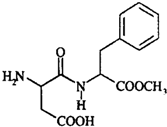 阿斯巴甜具有清爽的甜味,甜度约为蔗糖的200倍,其结构简式如图所示.下列关于阿斯巴甜的说法错误的是( )
阿斯巴甜具有清爽的甜味,甜度约为蔗糖的200倍,其结构简式如图所示.下列关于阿斯巴甜的说法错误的是( )
 阿斯巴甜具有清爽的甜味,甜度约为蔗糖的200倍,其结构简式如图所示.下列关于阿斯巴甜的说法错误的是( )
阿斯巴甜具有清爽的甜味,甜度约为蔗糖的200倍,其结构简式如图所示.下列关于阿斯巴甜的说法错误的是( )| A. | 阿斯巴甜属于糖类 | |
| B. | 在一定条件下完全水解,产物中有两种氨基酸 | |
| C. | 既能与酸反应又能与碱反应 | |
| D. | 可发生取代反应和加成反应 |
4.下列各组顺序的排列正确的是( )
| A. | 金属性:Li<Mg<Al | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 酸性:H2SO4<H2CO3<HNO3 | D. | 沸点:H2O>H2S>H2Se |
 能盘是一个世界性的话题,如何充分利用能量、开发新能源,为人类服务是广大科技工作者不懈努力的目标.
能盘是一个世界性的话题,如何充分利用能量、开发新能源,为人类服务是广大科技工作者不懈努力的目标.