题目内容
10.氢气是一种理想的“绿色能源”,利用氢能需要选择合适的储氢材料.目前正在研究和使用的储氢材料有镁系合金、稀土系合金等.(1)已知:Mg(s)+H2(g═MgH2(s)△H=-74.5kJ•mol-1
Mg2Ni(s)+2H2(g═Mg2NiH4(s)△H=-64.4kJ•mol-1
则Mg2Ni(s)+2MgH2(s═2Mg(s)+Mg2NiH4(s)△H=+84.6kJ•mol-1
(2)储氢材料Mg(AlH4)2在110~200℃的反应为:Mg(AlH4)═MgH2+2Al+3H2↑.
反应中每转移3mol电子时,产生的H2在标准状况下的体积为33.6L.
(3)镧镍合金在一定条件下可吸收氢气形成氢化物:LaNi5(s)+3H2(g═LaNi5H6(s)△H<0,欲使LaNi5H6(s)释放出气态氢,根据平衡移动原理,可改变的条件是bc(填字母编号).
a.增加LaNi5H6(s)的量 b.升高温度 c.减小压强 d.使用催化剂
(4)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:

①某温度下,向恒容密闭容器中加入环己烷,起始浓度为a mol•L-1,平衡时苯的浓度为b mol•L-1,该反应的平衡常数K==$\frac{27{b}^{4}}{a-b}$mol3•L-3(用含a、b的代数式表示).
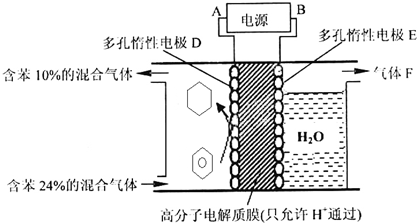
②一定条件下,下图装置可实现有机物的电化学储氢(忽略其它有机物).A是电源的负(填“正”或“负”)极;电解过程中产生的气体F为O2(填化学式),电极D上发生的电极反应为C6H6+6H++6e-=C6H12.
分析 (1)依据给出的热化学方程式利用盖斯定律计算反应热;
(2)根据化学方程式Mg(AlH4)2═MgH2+2Al+3H2↑计算;
(3)根据LaNi5(s)+3H2(g)?LaNi5H6(s)△H<0,欲使LaNi5H6 (s)释放出气态氢,则平衡向逆向移动,据此分析;
(4)①依据平衡常数表达式解答;
②该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷.
解答 解:(1)①Mg(s)+H2(g)═MgH2(s)△H1=-74.5kJ•mol-1
②Mg2Ni(s)+2H2(g)═Mg2NiH4(s)△H2=-64.4kJ•mol-1
Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3
由盖斯定律②-2×①得到Mg2Ni(s)+2MgH2(g)═2Mg(s)+Mg2NiH4(s)△H3 =-64.4KJ/mol-2×(-74.5KJ/mol)=+84.6KJ/mol,则△H3=+84.6KJ/mol,
故答案为:+84.6;
(2)储氢材料Mg(AlH4)2在110℃-200℃的反应为:Mg(AlH4)2=MgH2+2Al+3H2↑,从方程式可知反应中每转移6mol电子时生成3mol,所以反应中每转移3mol电子时产生的H2的物质的量为1.5,生成氢气33.6L;
故答案为:33.6;
(3)欲使LaNi5H6 (s)释放出气态氢,则平衡向逆向移动,由LaNi5(s)+3H2(g)?LaNi5H6(s)△H<0为气体减小的放热反应,所以可以升高温度或降低压强,平衡向逆向移动;
故答案为:bc;
(4)①环己烷的起始浓度为amol•L-1,平衡时苯的浓度为bmol•L-1,同一容器中各物质反应的物质的量浓度之比等于其计量数之比,所以根据方程式知,环己烷的平衡浓度为(a-b)mol/L,氢气的浓度为3bmol/L,则平衡常数K=$\frac{C(C{\;}_{6}H{\;}_{6})C{\;}^{3}(H{\;}_{2})}{C(C{\;}_{6}H{\;}_{12})}$=$\frac{27{b}^{4}}{a-b}$ mol3•L-3;
故答案为:$\frac{27{b}^{4}}{a-b}$ mol3•L-3;
该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,电解池阴极与电源负极相连,得出电解过程中产生的气体F为O2,阴极上苯得电子和氢离子生成环己烷,电极反应式为C6H6+6H++6e-=C6H12,
故答案为:负; O2;C6H6+6H++6e-=C6H12.
点评 本题考查了盖斯定律的应用、化学平衡的移动、平衡常数的计算及其电解池原理等知识点,题目难度较大,注意对相关知识的理解.

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案| A. | 要检验溴乙烷中的溴元素,可以加入NaOH溶液共热,冷却后滴入AgNO3溶液,观察有无浅黄色沉淀生成 | |
| B. | 要检验蔗糖的水解产物,将蔗糖的水解液加入到新制的氢氧化铜悬浊液中,加热至沸腾观察是否有红色沉淀产生 | |
| C. | 在进行溴乙烷与NaOH乙醇溶液反应的实验中,将反应产生的气体直接通入到酸性高锰酸钾溶液中来检验产生的气体是否为乙烯 | |
| D. | 将铜丝在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,铜丝恢复成原来的红色,取出,铜丝又会变为黑色,反复几次,用氢氧化铜悬浊液可以证明是否生成了乙醛 |
| A. | H2O | B. | CaCl2 | C. | NH4Cl | D. | Na2O2 |
| A. | 乙酸与乙酸乙酯 | B. | 溴苯与水 | C. | 酒精与水 | D. | 苯与CCl4 |
| A. | 用CuSO4溶液将ZnS转化成CuS沉淀:S2-+Cu2+═CuS↓ | |
| B. | NH4HCO3溶液与过量NaOH溶液混合加热:NH${\;}_{4}^{+}$+OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 向酸化的FeSO4溶液中滴入少量H2O2溶液:H2O2+2Fe2++2H+═2Fe3++2H2O | |
| D. | 用惰性电极电解饱和的KCl溶液:2H++2Cl$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2 |
| A. | Na | B. | Si | C. | P | D. | S |
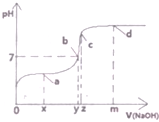 (1)25℃时,向20mL0.1mol•L的醋酸溶液中不断滴入0.1mol•L-1的NaOH溶液,溶液的pH变化曲线如图所示.
(1)25℃时,向20mL0.1mol•L的醋酸溶液中不断滴入0.1mol•L-1的NaOH溶液,溶液的pH变化曲线如图所示.
 C、${\;}_{6}^{12}$C和${\;}_{6}^{14}$C D、甲烷和丙烷.
C、${\;}_{6}^{12}$C和${\;}_{6}^{14}$C D、甲烷和丙烷.