15.下列说法正确的是( )
| A. | 每一个化学反应都会伴随着能量变化 | |
| B. | 氯化氢溶于水氢氯共价键被破坏 | |
| C. | 化学键的断裂和形成是化学反应能量变化的主要原因 | |
| D. | 离子化合物一定由金属元素和非金属元素组成,非金属元素之间不能形成离子化合物 |
14.化学与生产、生活密切相关.下列叙述正确的是( )
| A. | 加热蒸干MgCl2饱和溶液,可制得氯化镁固体 | |
| B. | 明矾可用于水的消毒、杀菌 | |
| C. | 使用无磷洗衣粉,可缓解水体富营养化问题 | |
| D. | 用加热法可除去硬水中的CaCl2、MgCl2 |
12.减少二氧化碳的排放,氮氧化物、二氧化硫的处理与利用是一项重要的热点课题.
Ⅰ.(1)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H 在0.1MPa时,按n(CO2):n(H2)=1:3投料,图1所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系.
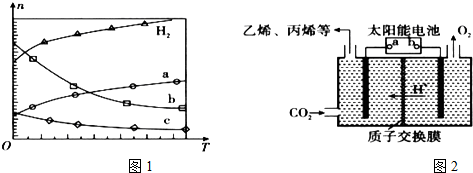
①该反应的△H<0(填“>”、“=”或“<”).
②曲线b表示的物质为H2O.
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是加压(或不断分离出水).
(2)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如图2所示.
b为电源的正极,电解时,生成乙烯的电极反应式是2CO2+12e-+12H+=C2H4+4H2O.
Ⅱ.(3)用活性炭还原法可以处理氮氧化物.如反应:C(s)+2NO(g)?N2(g)+CO2(g)△H=Q kJ•mol-1.
在T1℃时,反应进行到不同时间测得各物质的浓度如下:
①Tl℃时,该反应的平衡常数K=$\frac{9}{16}$.
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是通入一定量的NO;适当缩小容器的体积;增大压强;通入等物质的量的CO2和N2(答一种即可).
Ⅲ.(4)工业上可以用NaOH溶液或氨水吸收过量的SO2,分别生成NaHSO3、NH4HSO3,其水溶液均呈酸性.相同条件下,同浓度的两种酸式盐的水溶液中c(SO32-)较小的是NH4HSO3,用文字和化学用语解释原因HSO3-?H++SO32-,NH4+水解使c(H+)增大,电离平衡逆向移动,c(SO32-)浓度减小.
Ⅰ.(1)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H 在0.1MPa时,按n(CO2):n(H2)=1:3投料,图1所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系.

①该反应的△H<0(填“>”、“=”或“<”).
②曲线b表示的物质为H2O.
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是加压(或不断分离出水).
(2)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如图2所示.
b为电源的正极,电解时,生成乙烯的电极反应式是2CO2+12e-+12H+=C2H4+4H2O.
Ⅱ.(3)用活性炭还原法可以处理氮氧化物.如反应:C(s)+2NO(g)?N2(g)+CO2(g)△H=Q kJ•mol-1.
在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间(min) 浓度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是通入一定量的NO;适当缩小容器的体积;增大压强;通入等物质的量的CO2和N2(答一种即可).
Ⅲ.(4)工业上可以用NaOH溶液或氨水吸收过量的SO2,分别生成NaHSO3、NH4HSO3,其水溶液均呈酸性.相同条件下,同浓度的两种酸式盐的水溶液中c(SO32-)较小的是NH4HSO3,用文字和化学用语解释原因HSO3-?H++SO32-,NH4+水解使c(H+)增大,电离平衡逆向移动,c(SO32-)浓度减小.
11.下列各组内的物质属于同系物的是( )
| A. | CH3CH3 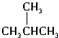 CH3CH2CH2CH2CH3 CH3CH2CH2CH2CH3 | |
| B. | CH3-CH3 CH2=CH-CH3 CH3CH=CHCH3 | |
| C. | 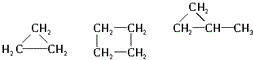 | |
| D. | CH3CH2CH2CH2CH3 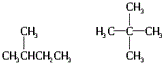 |
10.下列离子化合物的电子式不正确的是( )
| A. | 氯化钙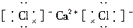 | B. | 硫化钠 | C. | 氮气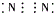 | D. | 二氧化碳 |
8.用CO还原15.0g某磁铁矿石样品(所含的杂质不参加反应),生成的CO2再跟过量的石灰水反应,得到19.2g沉淀.则求磁铁矿石中Fe3O4的质量分数为( )
| A. | 68.3% | B. | 74.2% | C. | 92.2% | D. | 78.1% |
7.下列离子方程式正确的是( )
0 169533 169541 169547 169551 169557 169559 169563 169569 169571 169577 169583 169587 169589 169593 169599 169601 169607 169611 169613 169617 169619 169623 169625 169627 169628 169629 169631 169632 169633 169635 169637 169641 169643 169647 169649 169653 169659 169661 169667 169671 169673 169677 169683 169689 169691 169697 169701 169703 169709 169713 169719 169727 203614
| A. | 氯化铵与氢氧化钠两种稀溶液混合:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$H2O+NH3↑ | |
| B. | 用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O | |
| C. | 氢氧化镁与稀硫酸反应:H++OH-=H2O | |
| D. | 单质铜与稀硝酸反应:Cu+2H++2NO3-=Cu2++2NO↑+H2O |
 ,五种元素原子半径从大到小的顺序是Na>Si>O>F>H (填元素符号);
,五种元素原子半径从大到小的顺序是Na>Si>O>F>H (填元素符号); 、
、 ;
;