题目内容
10.下列离子化合物的电子式不正确的是( )| A. | 氯化钙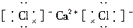 | B. | 硫化钠 | C. | 氮气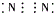 | D. | 二氧化碳 |
分析 A.氯化钙为离子化合物,一个钙离子与两个氯离子通过离子键结合;
B.硫化钠为离子化合物,一个硫离子与两个钠离子通过离子键结合;
C.氮气中存在三对共用电子对,为氮氮三键;
D.二氧化碳分子中含有两个碳氧双键,碳原子最外层为8个电子.
解答 解:A.氯化钙为离子化合物,电子式为: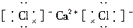 ,故A正确;
,故A正确;
B.硫化钠为离子化合物,电子式为: ,故B正确;
,故B正确;
C.氮气的电子式为 ,故C正确;
,故C正确;
D.二氧化碳为直线型结构,分子中存在两个碳氧双键,二氧化碳的电子式为 ,故D错误;
,故D错误;
故选:D.
点评 本题考查了常见化学用语的判断,熟悉物质的结构及所含化学键类型是解题关键,题目难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
12.下列说法不正确的是( )
| A. | 采用原煤脱硫技术,可减少燃煤产生的SO2,从而有效降低酸雨的产生和危害 | |
| B. | FeCl2、CuS、SO3、NO2都不能由单质间直接化合得到 | |
| C. | SO2既可以由硫的化合物氧化得到,又可以由硫的化合物还原得到 | |
| D. | 硫为不溶于水,易溶于酒精和CS2的黄色粉末 |
10.甲、乙、丙、丁分别是Na2SO3、AgNO3、HCl、BaCl2四种无色溶液中的一种,它们两两反应后的现象如下:
甲+乙→沉淀,甲+丙→沉淀,乙+丙→沉淀,丙+丁→沉淀,乙+丁→无色刺激性气味气体,则甲、乙、丙、丁依次是( )
甲+乙→沉淀,甲+丙→沉淀,乙+丙→沉淀,丙+丁→沉淀,乙+丁→无色刺激性气味气体,则甲、乙、丙、丁依次是( )
| A. | Na2SO3 HCl AgNO3 BaCl2 | B. | BaCl2 Na2SO3 HCl AgNO3 | ||
| C. | BaCl2 Na2SO3 AgNO3 HCl | D. | AgNO3 HCl BaCl2 Na2SO3 |
5.对四种金属G、L、M、R进行如下实验:
根据表中所给实验结果,判断这四种金属活动性由强到弱的次序正确的是( )
| 实验 金属 | G | L | M | R |
| 和冷水反应 | 无反应 | 慢慢反应 | 未做 | 未做 |
| 和2mol/L HCl 反应 | 溶解并放出气体 | 溶解并放出气体 | 无反应 | 无反应 |
| 和Rn+的水溶液反应 | 溶解并形成沉淀 | 未做 | 溶解并形成沉淀 | 未做 |
| A. | L、G、R、M | B. | G、L、M、R | C. | L、G、M、R | D. | L、R、G、M |
15.下列说法正确的是( )
| A. | 每一个化学反应都会伴随着能量变化 | |
| B. | 氯化氢溶于水氢氯共价键被破坏 | |
| C. | 化学键的断裂和形成是化学反应能量变化的主要原因 | |
| D. | 离子化合物一定由金属元素和非金属元素组成,非金属元素之间不能形成离子化合物 |
2.构成下列四种物质的微粒间,既存在离子键又存在共价键的是( )
| A. | MgCl2 | B. | K2S | C. | NaOH | D. | SO3 |
20.固体乙醇晶体中不存在的作用力是( )
| A. | 离子键 | B. | 氢键 | C. | 非极性键 | D. | 范德华力 |