5.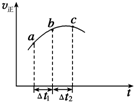 向绝热恒容密闭容器中通入SO2和NO2一定条件下使反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示,由图可得出的正确结论是( )
向绝热恒容密闭容器中通入SO2和NO2一定条件下使反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示,由图可得出的正确结论是( )
 向绝热恒容密闭容器中通入SO2和NO2一定条件下使反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示,由图可得出的正确结论是( )
向绝热恒容密闭容器中通入SO2和NO2一定条件下使反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示,由图可得出的正确结论是( )| A. | △t1=△t2时,SO2的转化率:a~b段小于b~c段 | |
| B. | 反应物的总能量低于生成物的总能量 | |
| C. | 反应物浓度:a点小于b点 | |
| D. | 反应在C点达到平衡状态 |
4.已知化学反应①C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-Q1 kJ/mol②2CO(g)+O2(g)═2CO2(g)△H=-Q2 kJ/mol.据此判断,下列说法正确的是(Q1、Q2均为正数,且其他条件相同)( )
| A. | C的燃烧热为Q1 kJ/mol | |
| B. | 2 mol CO(g)所具有的能量一定高于2 mol CO2(g)所具有的能量 | |
| C. | 一定质量的C燃烧,生成CO2(g)比生成CO(g)时放出的热量多 | |
| D. | C燃烧生成CO2气体的热化学方程式为:C(s)+O2(g)═CO2(g)△H=-(Q1+Q2) kJ/mol |
3.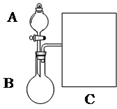 氨水是一种的常用的化学试剂.
氨水是一种的常用的化学试剂.
(1)以浓氨水和生石灰为原料,用如下装置为发生装置,可制取少量氨 气.已知:NH3•H2O+CaO═Ca(OH)2+NH3↑.
①生石灰应该装在B(填A或B).
②试从电离平衡角度分析该实验中氨气逸出的原因:CaO与水反应生成Ca(OH)2,溶液中OH-浓度增大,使NH3+H2O?NH4++OH-平衡逆向移动,有利于NH3逸出
③现要用试管和必要实验用品收集一试管氨气,请在C处补充相应收集装置.
(2)化学兴趣小组用氨水与硝酸银溶液配制好银氨溶液后,进行乙醛的银镜反应实验,但部分同学实验时间长,且效果不明显.影响乙醛银镜反应速率的因素有哪些呢?请你完成如下猜想:
①猜想:因素一:银氨溶液的pH大小;
因素二:水浴加热的条件.
②你设计实验验证上述“因素一”,完成下表中内容.
提供试剂:乙醛、2%稀氨水、0.25mol/L NaOH溶液、盐酸、2% AgNO3溶液
实验用品:烧杯(装有热水)、试管
 氨水是一种的常用的化学试剂.
氨水是一种的常用的化学试剂.(1)以浓氨水和生石灰为原料,用如下装置为发生装置,可制取少量氨 气.已知:NH3•H2O+CaO═Ca(OH)2+NH3↑.
①生石灰应该装在B(填A或B).
②试从电离平衡角度分析该实验中氨气逸出的原因:CaO与水反应生成Ca(OH)2,溶液中OH-浓度增大,使NH3+H2O?NH4++OH-平衡逆向移动,有利于NH3逸出
③现要用试管和必要实验用品收集一试管氨气,请在C处补充相应收集装置.
(2)化学兴趣小组用氨水与硝酸银溶液配制好银氨溶液后,进行乙醛的银镜反应实验,但部分同学实验时间长,且效果不明显.影响乙醛银镜反应速率的因素有哪些呢?请你完成如下猜想:
①猜想:因素一:银氨溶液的pH大小;
因素二:水浴加热的条件.
②你设计实验验证上述“因素一”,完成下表中内容.
提供试剂:乙醛、2%稀氨水、0.25mol/L NaOH溶液、盐酸、2% AgNO3溶液
实验用品:烧杯(装有热水)、试管
| 实验步骤 | 实验操作 | 预期现象及结论 (步骤1只写现象) |
| 1 | 在A、B两支洁净的试管中各加入1mL 2%的AgNO3溶液,然后边振荡试管边逐滴滴入2%稀氨水,至沉淀恰好溶解,此时制得pH均约为8的银氨溶液. | 先生成白色沉淀 后沉淀溶解 |
| 2 | 往A、B试管加入3滴乙醛,然后在A试管中加1滴NaOH溶液;振荡后将两支试管放在热水浴中温热. | 若A试管比B试管出现的银镜时间短、光亮,则则溶液pH大 反应速率快; 若A试管比B试管出现的银镜时间长,则则溶液pH大 反应速率慢. |
2.某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01mol/L、0.001mol/L,催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液(0.1mol/L)的用量均为2mL.
(1)该反应的化学方程式为5H2C2O4+2KMnO4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
(2)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
(3)某同学对实验①和②进行了三次实验测得以下实验数据(从混合振荡均匀开始计时):
计算用0.001mol•L-1 KMnO4酸性溶液进行实验时KMnO4的平均反应速率:1×10-4mol?L-1?min-1.(忽略混合前后溶液的体积变化)
(4)某同学取一定量草酸溶液装入试管,加入一定体积的酸性高锰酸钾溶液,振荡试管,发现溶液开始缓慢褪色,后来迅速变成无色.(反应热效应不明显,可忽略不计),该反应的反应速率迅速加快的主要原因可能是反应生成的MnSO4作为该反应的催化剂.
(1)该反应的化学方程式为5H2C2O4+2KMnO4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
(2)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 催化剂用量/g | KMnO4酸性溶液浓度mol/L | 实验目的 |
| ① | 298 | 0.5 | 0.01 | (Ⅰ)实验①和②探究KMnO4酸性溶液的浓度对反应速率的影响 (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究催化剂对该反应速率的 影响; |
| ② | ||||
| ③ | 323 | |||
| ④ |
| KMnO4酸性溶液的浓度/mol•L-1 | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
(4)某同学取一定量草酸溶液装入试管,加入一定体积的酸性高锰酸钾溶液,振荡试管,发现溶液开始缓慢褪色,后来迅速变成无色.(反应热效应不明显,可忽略不计),该反应的反应速率迅速加快的主要原因可能是反应生成的MnSO4作为该反应的催化剂.
1.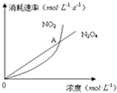 在80℃时,将0.40mol 的N2O4气体充入2L 已经抽成真空的固定容积的密闭容器中,发生如下反应:N2O4(g)?2NO2(g)△H=+56.9kJ/mol,隔一段时间对该容器内的物质进行分析,得到如下数据:
在80℃时,将0.40mol 的N2O4气体充入2L 已经抽成真空的固定容积的密闭容器中,发生如下反应:N2O4(g)?2NO2(g)△H=+56.9kJ/mol,隔一段时间对该容器内的物质进行分析,得到如下数据:
(1)计算在80℃时该反应的平衡常数K=1.8.
(2)反应进行至100s 后将反应混合物的温度降低,混合气体的颜色变浅(填“变浅”、“变深”或“不变”).
(3)要增大该反应的K值,可采取的措施有D(填序号).
A.增大N2O4起始浓度 B.向混合气体中通入NO2C.使用高效催化剂 D.升高温度
(4)当反应达到平衡后,下列操作,不能使平衡混合气体颜色加深的是D
A.恒温恒容下再通入N2O4气体
B.恒温恒容下再通入NO2气体
C.恒容时,升高温度
D.恒温恒容时通入Ar
E.恒温时压缩体积
(5)图中,交点A表示该反应的所处的状态为B
A.平衡状态 B.朝正反应方向移动C.朝逆反应方向移动 D.无法判断.
 在80℃时,将0.40mol 的N2O4气体充入2L 已经抽成真空的固定容积的密闭容器中,发生如下反应:N2O4(g)?2NO2(g)△H=+56.9kJ/mol,隔一段时间对该容器内的物质进行分析,得到如下数据:
在80℃时,将0.40mol 的N2O4气体充入2L 已经抽成真空的固定容积的密闭容器中,发生如下反应:N2O4(g)?2NO2(g)△H=+56.9kJ/mol,隔一段时间对该容器内的物质进行分析,得到如下数据:| 时间/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(2)反应进行至100s 后将反应混合物的温度降低,混合气体的颜色变浅(填“变浅”、“变深”或“不变”).
(3)要增大该反应的K值,可采取的措施有D(填序号).
A.增大N2O4起始浓度 B.向混合气体中通入NO2C.使用高效催化剂 D.升高温度
(4)当反应达到平衡后,下列操作,不能使平衡混合气体颜色加深的是D
A.恒温恒容下再通入N2O4气体
B.恒温恒容下再通入NO2气体
C.恒容时,升高温度
D.恒温恒容时通入Ar
E.恒温时压缩体积
(5)图中,交点A表示该反应的所处的状态为B
A.平衡状态 B.朝正反应方向移动C.朝逆反应方向移动 D.无法判断.
19.已知:①N2(g)+O2(g)═2NO(g)△H1=+180kJ•mol-1
②N2(g)+3H2(g)?2NH3(g)△H2=-92.4kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)△H3=-483.6kJ•mol-1
下列说法正确的是( )
0 169527 169535 169541 169545 169551 169553 169557 169563 169565 169571 169577 169581 169583 169587 169593 169595 169601 169605 169607 169611 169613 169617 169619 169621 169622 169623 169625 169626 169627 169629 169631 169635 169637 169641 169643 169647 169653 169655 169661 169665 169667 169671 169677 169683 169685 169691 169695 169697 169703 169707 169713 169721 203614
②N2(g)+3H2(g)?2NH3(g)△H2=-92.4kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)△H3=-483.6kJ•mol-1
下列说法正确的是( )
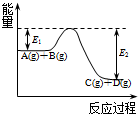
| A. | 据反应①可知N2的燃烧热为180 kJ•mol-1 | |
| B. | 2H2O(l)═2H2(g)+O2(g)△H>+483.6 kJ•mol-1 | |
| C. | 反应②在恒温恒容密闭容器反应达平衡后,充入N2,平衡正向移动,氮气的转化率减小,该反应的平衡常数增加 | |
| D. | 可推知,氨的催化氧化的热化学方程式为4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H=-906 kJ•mol-1 |
 (1)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).丙烷脱氢可得丙烯.
(1)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).丙烷脱氢可得丙烯. 随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.
随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.