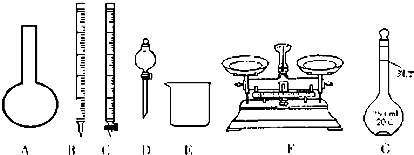
5.如图所示是气体性质实验的常用装置,下列有关实验现象的说法不正确的是( )

| A. | 若水槽中是水,试管中是NO2,可看到液面上升,若充入一定量的O2可使液体充满整个试管 | |
| B. | 若水槽中是NaOH溶液,试管中是Cl2,可看到液面上升、试管中黄绿色褪去 | |
| C. | 若水槽中是水并滴有几滴紫色石蕊,试管中是SO2,可看到液面上升并变为无色 | |
| D. | 若水槽中是水并滴有几滴酚酞,试管中是NH3,可看到液面上升并呈红色 |
4.以下物质间的每步转化通过一步反应能实现的是( )
| A. | Al→Al2O3→Al(OH)3→NaAlO2 | B. | Si→SiO2→H2SiO3→Na2SiO3 | ||
| C. | N2→NO→NO2→HNO3 | D. | S→SO3→H2SO4→MgSO4 |
1.下列物质中属于同素异形体的是( )
| A. | H2O和H2O2 | B. | 12C和14C | C. | O2和O3 | D. | SO2和SO3 |
19.通过复习总结,下列归纳正确的是( )
0 169515 169523 169529 169533 169539 169541 169545 169551 169553 169559 169565 169569 169571 169575 169581 169583 169589 169593 169595 169599 169601 169605 169607 169609 169610 169611 169613 169614 169615 169617 169619 169623 169625 169629 169631 169635 169641 169643 169649 169653 169655 169659 169665 169671 169673 169679 169683 169685 169691 169695 169701 169709 203614
| A. | 有单质参加的反应,置换反应一定都属于氧化还原反应 | |
| B. | 简单非金属阴离子只有还原性,而金属阳离子只有氧化性 | |
| C. | 离子化合物在熔融态都能够导电,共价化合物在熔融态都不导电 | |
| D. | 所有物质都有化学键 |

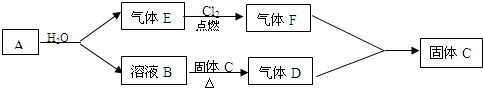
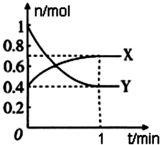 在一定温度下,体积为4L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4(g)(无色),如图所示.
在一定温度下,体积为4L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4(g)(无色),如图所示.