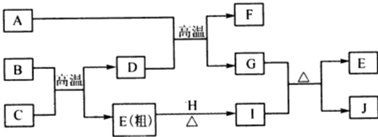
12.用无机矿物资源生产部分材料,其产品流程示意图如下.下列有关说法不正确的是( )
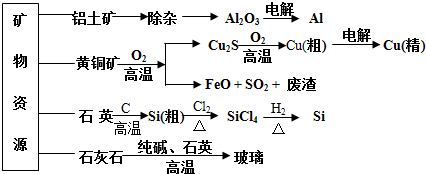

| A. | 制取玻璃的同时产生CO2气体,制取粗硅时生成的气体产物为CO | |
| B. | 黄铜矿冶炼铜时产生的SO2可用于生产硫酸,FeO可用作冶炼铁的原料 | |
| C. | 粗硅制高纯硅时,提纯四氯化硅可用多次蒸馏的方法 | |
| D. | 生产高纯硅、铝、铜及玻璃的过程中都涉及氧化还原反应 |
11.已知25℃时:
①HF(aq)+OH-(aq)═F-(aq)+H2O(l)△H1=-67.7kJ•mol-1
②H+(aq)+OH-(aq)═H2O(l)△H2=-57.3kJ•mol-1
③Ba2+(aq)+SO42-(aq)═BaSO4(s)△H3<0
下列说法正确的是( )
①HF(aq)+OH-(aq)═F-(aq)+H2O(l)△H1=-67.7kJ•mol-1
②H+(aq)+OH-(aq)═H2O(l)△H2=-57.3kJ•mol-1
③Ba2+(aq)+SO42-(aq)═BaSO4(s)△H3<0
下列说法正确的是( )
| A. | HF的电离方程式及热效应:HF(aq)═H+(aq)+F-(aq)△H>0 | |
| B. | 在氢氧化钠溶液与盐酸的反应中,盐酸量一定,氢氧化钠溶液量越多,中和热越大 | |
| C. | △H2=-57.3 kJ•mol-1是强酸和强碱在稀溶液中反应生成可溶盐的中和热 | |
| D. | 稀硫酸与稀氢氧化钡溶液反应的热化学方程式为:H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+2H2O(l)△H=-114.6 kJ•mol-1 |
10.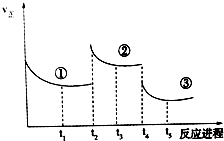 已知:2SO2(g)+O2(g)═2SO3(g)△H=-196.6kJ•mol-1,向密闭容器中加入2mol SO2和1mol O2,一定条件下反应达到平衡,在t2和t4时刻分别只改变一个条件(温度或压强),反应过程中正反应速率如图所示,下列说法正确的是 ( )
已知:2SO2(g)+O2(g)═2SO3(g)△H=-196.6kJ•mol-1,向密闭容器中加入2mol SO2和1mol O2,一定条件下反应达到平衡,在t2和t4时刻分别只改变一个条件(温度或压强),反应过程中正反应速率如图所示,下列说法正确的是 ( )
注:t1~t2、t3~t4、t5之后各时间段表示达到平衡状态①、②、③
 已知:2SO2(g)+O2(g)═2SO3(g)△H=-196.6kJ•mol-1,向密闭容器中加入2mol SO2和1mol O2,一定条件下反应达到平衡,在t2和t4时刻分别只改变一个条件(温度或压强),反应过程中正反应速率如图所示,下列说法正确的是 ( )
已知:2SO2(g)+O2(g)═2SO3(g)△H=-196.6kJ•mol-1,向密闭容器中加入2mol SO2和1mol O2,一定条件下反应达到平衡,在t2和t4时刻分别只改变一个条件(温度或压强),反应过程中正反应速率如图所示,下列说法正确的是 ( )注:t1~t2、t3~t4、t5之后各时间段表示达到平衡状态①、②、③
| A. | t2~t3时间段,平衡向逆反应方向移动 | |
| B. | t4时刻改变的条件是减小压强 | |
| C. | 平衡状态①和②,SO2转化率相同 | |
| D. | 平衡状态①和②,平衡常数K值相同 |
6.下列化合物中,属于氧化物的是( )
0 169503 169511 169517 169521 169527 169529 169533 169539 169541 169547 169553 169557 169559 169563 169569 169571 169577 169581 169583 169587 169589 169593 169595 169597 169598 169599 169601 169602 169603 169605 169607 169611 169613 169617 169619 169623 169629 169631 169637 169641 169643 169647 169653 169659 169661 169667 169671 169673 169679 169683 169689 169697 203614
| A. | Na2SO4 | B. | NaOH | C. | HNO3 | D. | FeO |
 可用来制备抗凝血药,通过下列路线合成:
可用来制备抗凝血药,通过下列路线合成:
 .
. +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$ +CH3COONa+CH3OH+H2O.
+CH3COONa+CH3OH+H2O.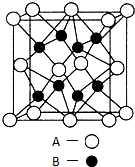 A、B、C、D、E是元素周期表中原子序数依次递增的前四周期元素.A原子最外层电子数为内层电子数的3倍;B的焰色反应呈黄色;C的氢化物是一种强酸,其浓溶液可与A、E的化合物反应生成C的单质;D是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:
A、B、C、D、E是元素周期表中原子序数依次递增的前四周期元素.A原子最外层电子数为内层电子数的3倍;B的焰色反应呈黄色;C的氢化物是一种强酸,其浓溶液可与A、E的化合物反应生成C的单质;D是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:
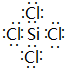 .
.