15.下列各组物质发生反应后,只可能生成一种气体产物的是( )
| A. | 木炭在氧气中燃烧 | B. | 铁粉与高温水蒸气反应 | ||
| C. | 碳酸氢铵受热分解 | D. | Na2O2加入氯化铵溶液中 |
14.下列说法不正确的是( )
| A. | HCl、HBr、HI的熔点沸点升高与范德华力大小有关 | |
| B. | H2O的熔点沸点大于H2S的是由于H2O分子之间存在氢键 | |
| C. | 乙醇与水互溶可以用相似相溶原理解释 | |
| D. | 甲烷与水分子间不能形成氢键这种化学键 |
12.下列离子方程式正确的是( )
| A. | 向溴化亚铁溶液中通入少量氯气:2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O-→2C6H5OH+CO32- | |
| C. | 向硫酸氢钠溶液中滴入氢氧化钡溶液至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| D. | 将氢氧化铁粉末加入氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O |
11.下列变化中,属于物理变化的是( )
| A. | 煤干馏 | B. | 石油的减压分馏 | C. | 石油裂解 | D. | 煤液化 |
9.判断含氧酸强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强.如下表所示
(1)亚磷酸(H3PO3)和亚砷酸(H3AsO3)分子式相似,但它们的酸性差别很大,H3PO3是中强酸,H3AsO3既有弱酸性又有弱碱性.由此可推出它们的结构式分别为 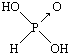 和
和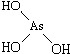 ,二者酸性强弱原因亚磷酸含有1个非羟基氧原子,而亚砷酸没有非羟基氧原子,故亚磷酸的酸性强于亚砷酸的酸性
,二者酸性强弱原因亚磷酸含有1个非羟基氧原子,而亚砷酸没有非羟基氧原子,故亚磷酸的酸性强于亚砷酸的酸性
(2)亚磷酸和亚砷酸与过量的氢氧化钠溶液反应的化学方程式分别为:①H3PO3+2NaOH=Na2HPO3+2H2O; ②H3AsO3+3NaOH=Na3AsO3+3H2O.
| 名称 | 次氯酸 | 磷酸 | 硫酸 | 高氯酸 |
| 结构式 | Cl-OH |  | 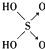 | 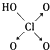 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
 和
和 ,二者酸性强弱原因亚磷酸含有1个非羟基氧原子,而亚砷酸没有非羟基氧原子,故亚磷酸的酸性强于亚砷酸的酸性
,二者酸性强弱原因亚磷酸含有1个非羟基氧原子,而亚砷酸没有非羟基氧原子,故亚磷酸的酸性强于亚砷酸的酸性(2)亚磷酸和亚砷酸与过量的氢氧化钠溶液反应的化学方程式分别为:①H3PO3+2NaOH=Na2HPO3+2H2O; ②H3AsO3+3NaOH=Na3AsO3+3H2O.
8.下列物质的熔、沸点高低顺序正确的是( )
| A. | 金刚石>晶体硅>二氧化硅>碳化硅 | B. | CI4>CBr4>CCl4>CH4 | ||
| C. | MgO>Na2O>N2>O2 | D. | 金刚石>生铁>纯铁>钠 |
6.环境污染已成为人类社会面临的重大威胁,下列各项中与环境污染无关的是( )
①温室效应;②赤潮;③酸雨;④光化学污染;⑤臭氧空洞;⑥工业含汞水排放;⑦潮汐现象; ⑧水华;⑨地方性甲状腺肿大.
0 169497 169505 169511 169515 169521 169523 169527 169533 169535 169541 169547 169551 169553 169557 169563 169565 169571 169575 169577 169581 169583 169587 169589 169591 169592 169593 169595 169596 169597 169599 169601 169605 169607 169611 169613 169617 169623 169625 169631 169635 169637 169641 169647 169653 169655 169661 169665 169667 169673 169677 169683 169691 203614
①温室效应;②赤潮;③酸雨;④光化学污染;⑤臭氧空洞;⑥工业含汞水排放;⑦潮汐现象; ⑧水华;⑨地方性甲状腺肿大.
| A. | ⑥⑧ | B. | ④⑤ | C. | ①②③ | D. | ⑦⑨ |
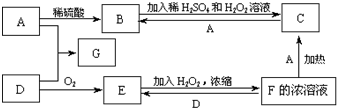 中学化学中几种常见物质的转化关系如图(有部分产物未画出).A是一种金属单质,D是一种非金属固体单质.
中学化学中几种常见物质的转化关系如图(有部分产物未画出).A是一种金属单质,D是一种非金属固体单质.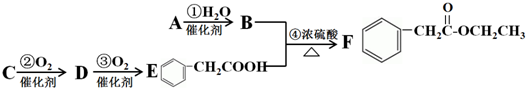
 .
.