4.X、Y、Z、W是四种短周期元素,有关它们的信息如下表所示.
请回答下列问题:
(1)X的单质分子X2的结构式是S=S.
(2)X、Y、Z三元素的最高价氧化物对应水化物的酸性由强到弱的顺序是HClO4>H2SO4>H2CO3(用化学式表示).
(3)常温时,W的硫酸盐溶液的pH<(填“=”、“>”或“<”)7,理由是Al3++3H2O?Al(OH)3+3H+(用离子方程式表示).
(4)25℃、101kPa时,32g Y的最简单气态氢化物完全燃烧生成稳定的氧化物时放出1780.6kJ的热量,写出该反应的热化学方程式:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol.
| 元素 | 部分结构知识 | 部分性质 |
| X | X原子核外电子占有9个原子轨道 | X的一种氧化物是形成酸雨的主要物质 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W原子的最外层电子数等于2n-3(n为原子核外电子层数) | 化学反应中W原子易失去最外层电子形成Wn+ |
(1)X的单质分子X2的结构式是S=S.
(2)X、Y、Z三元素的最高价氧化物对应水化物的酸性由强到弱的顺序是HClO4>H2SO4>H2CO3(用化学式表示).
(3)常温时,W的硫酸盐溶液的pH<(填“=”、“>”或“<”)7,理由是Al3++3H2O?Al(OH)3+3H+(用离子方程式表示).
(4)25℃、101kPa时,32g Y的最简单气态氢化物完全燃烧生成稳定的氧化物时放出1780.6kJ的热量,写出该反应的热化学方程式:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol.
3.下列化学反应的离子方程式正确的是( )
| A. | 在稀氨水中通入过量CO2:NH3•H2O+CO2=NH4++HCO3- | |
| B. | SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO | |
| C. | 向Ba(OH)2溶液中加入少量的NaHSO3溶液2HSO3-+Ba2++2OH-→BaSO3↓+SO32-+2H2O | |
| D. | 氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO42-=CaSO4↓+H2O |
20.部分短周期主族元素的原子半径数据如下表:
根据上表信息,判断下列说法正确的是( )
| 元素 | W | Q | M | R | X | Y |
| 原子半径/nm | 0.186 | 0.160 | 0.143 | 0.112 | 0.102 | 0.066 |
| 主要化合价 | +1 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 原子半径:Y<M<Q,所以原子序数:Y>M>Q | |
| B. | M、Q、W都是金属,且其单质与盐酸反应的速率:M>Q>W | |
| C. | Q2+与X2-的电子层结构相同,且X2-离子半径大于Q2+ | |
| D. | M的氧化物能与W的最高价氧化物的水化物反应 |
18.下表为元素周期表的一部分,表中列出10种元素在周期表中的位置,按要求回答下列各题
(1)化学性质最不活泼的元素符号是Ne,金属性最强的单质与水反应的化学方程式是2K+2H2O=2KOH+H2↑.
(2)画出④形成的简单离子的结构示意图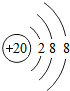 .
.
(3)①③⑤三种元素最高价氧化物的水化物中碱性最强的物质的化学式是NaOH.
(4)元素①形成的稳定的氧化物在呼吸面具中供氧时的化学方程式是:2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑.
(5)③⑤⑦三种元素形成的简单离子,离子半径由大到小的顺序是O2->Mg2+>Al3+.
(6)设计一个简单实验证明⑧⑨两种元素非金属性强弱的比较将氯气通入Na2S溶液中,如果溶液中出现浅黄色沉淀,就说明氯气的氧化性大于硫,则非金属性Cl>S.
 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑥ | ⑦ | ⑩ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑨ | |||
| 4 | ② | ④ |
(2)画出④形成的简单离子的结构示意图
 .
.(3)①③⑤三种元素最高价氧化物的水化物中碱性最强的物质的化学式是NaOH.
(4)元素①形成的稳定的氧化物在呼吸面具中供氧时的化学方程式是:2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑.
(5)③⑤⑦三种元素形成的简单离子,离子半径由大到小的顺序是O2->Mg2+>Al3+.
(6)设计一个简单实验证明⑧⑨两种元素非金属性强弱的比较将氯气通入Na2S溶液中,如果溶液中出现浅黄色沉淀,就说明氯气的氧化性大于硫,则非金属性Cl>S.
16.人的体味中存在两种名为AND和EST的荷尔蒙,结构如图所示.下列说法不正确的是( )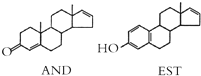
0 169492 169500 169506 169510 169516 169518 169522 169528 169530 169536 169542 169546 169548 169552 169558 169560 169566 169570 169572 169576 169578 169582 169584 169586 169587 169588 169590 169591 169592 169594 169596 169600 169602 169606 169608 169612 169618 169620 169626 169630 169632 169636 169642 169648 169650 169656 169660 169662 169668 169672 169678 169686 203614

| A. | AND和EST都能使酸性 KMnO4溶液褪色 | |
| B. | AND和EST两者的相对分子质量之差为14 | |
| C. | AND和EST分别与足量氢气加成后的两种生成物互为同系物 | |
| D. | AND和EST与溴水完全反应消耗溴单质的物质的量之比为2:3 |
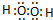 ,该分子含有极性键和非极性键(填“极性”、“非极性”)键
,该分子含有极性键和非极性键(填“极性”、“非极性”)键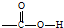
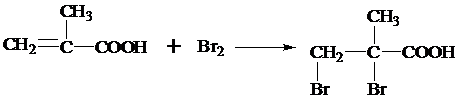 ,反应类型为加成反应.
,反应类型为加成反应.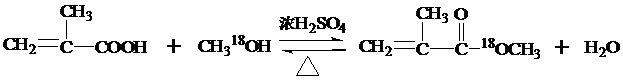 ,该酯化反应生成的产物在一定条件下可以发生加聚反应得到有机玻璃,有机玻璃的结构简式为
,该酯化反应生成的产物在一定条件下可以发生加聚反应得到有机玻璃,有机玻璃的结构简式为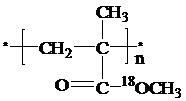 .
. .
.