题目内容
20.部分短周期主族元素的原子半径数据如下表:| 元素 | W | Q | M | R | X | Y |
| 原子半径/nm | 0.186 | 0.160 | 0.143 | 0.112 | 0.102 | 0.066 |
| 主要化合价 | +1 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 原子半径:Y<M<Q,所以原子序数:Y>M>Q | |
| B. | M、Q、W都是金属,且其单质与盐酸反应的速率:M>Q>W | |
| C. | Q2+与X2-的电子层结构相同,且X2-离子半径大于Q2+ | |
| D. | M的氧化物能与W的最高价氧化物的水化物反应 |
分析 在短周期元素中,Q、R化合价为+2价,由原子半径可知Q为Mg,R为Be;W化合价为+1价,原子半径W>Q,故W为Na;X和Y的化合价都有-2价,应为周期表第ⅥA族元素,X的最高价为+6价,X应为S元素,Y无正价,Y应为O元素;M的化合价为+3价,应为周期表第ⅢA族元素,M半径大于X小于Q,M为Al元素,结合元素周期律知识解答该题.
解答 解:在短周期元素中,Q、R化合价为+2价,由原子半径可知Q为Mg,R为Be;W化合价为+1价,原子半径W>Q,故W为Na;X和Y的化合价都有-2价,应为周期表第ⅥA族元素,X的最高价为+6价,X应为S元素,Y无正价,Y应为O元素;M的化合价为+3价,应为周期表第ⅢA族元素,M半径大于X小于Q,M为Al元素.
A、Y为O是第二周期元素,MQ为第三周期元素,则原子序数:M>Q>Y,故A错误;
B、同周期从左到右金属性依次减弱,与酸反应的速率减慢,所以其单质与盐酸反应的速率:W>Q>M,故B错误;
C、Q2+的核外有10个电子,X2-的核外有18个电子,则电子层结构不相同,且X2-离子半径大于Q2+,故C错误;
D、M的氧化物为两性氧化物,能与W的最高价氧化物的水化物反应,故D正确,
故选:D.
点评 本题考查元素位置结构和性质的关系及应用,难度中等,正确把握元素化合价、原子半径与元素性质的关系是解答该题的关键,注意元素周期律灵活应用.

练习册系列答案
相关题目
10.纯羊毛线和聚酯纤维(结构如图)均是纺织、服装行业常用的材料.下列说法正确的是( )


| A. | 羊毛与聚酯纤维的化学成分相同 | |
| B. | 聚酯纤维和羊毛在一定条件下均能水解 | |
| C. | 该聚酯纤维的单体为对苯二甲酸和乙醇 | |
| D. | 聚酯纤维属于纯净物 |
15.对下列实验现象的解释正确的是( )
| 现 象 | 解 释 | |
| A | Na2O2 投入到 FeCl2 溶液中得到大量红褐色沉淀 | Na2O2 具有还原性 |
| B | 浓硝酸在光照条件下变黄 | 浓硝酸不稳定,生成的有色产物能溶于浓硝酸 |
| C | 向某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 说明该溶液中含有SO42- |
| D | 向盐酸中加入浓硫酸时产生白雾 | 说明浓硫酸具有脱水性 |
| A. | A | B. | B | C. | C | D. | D |
12.下列化学反应中,光照对它几乎没有影响的是( )
| A. | 氯气与氢气的反应 | B. | 氯气与甲烷的反应 | ||
| C. | 次氯酸的分解反应 | D. | 甲烷的分解反应 |
9.下列化学反应中水作氧化剂的是( )
| A. | SO2+H2O | B. | Fe+H2O | C. | Cl2+H2O | D. | NO2+H2O |
10.下列分子式一定表示纯净物的是( )
| A. | C4H10 | B. | C3H8 | C. | C5H12 | D. | C3H7Cl |
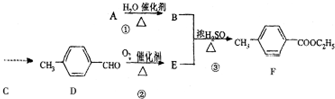
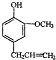 )是一种重要的调味剂,它与F的关系是b.
)是一种重要的调味剂,它与F的关系是b.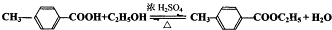 .
.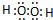 ,该分子含有极性键和非极性键(填“极性”、“非极性”)键
,该分子含有极性键和非极性键(填“极性”、“非极性”)键