19.请回答下列问题:
(1)N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:
则该元素是Al(填写元素符号).
(2)基态锗(Ge)原子的价层电子排布式是4s24p2.Ge的最高价溴化物分子式是GeBr4.该元素可能的性质或应用有BD.
A.是一种活泼的金属元素 B.其单质可作为半导体材料
C.其元素的电负性大于硫元素 D.其最高价氯化物的沸点低于其溴化物的沸点
(3)关于化合物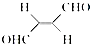 ,下列叙述正确的有AD.
,下列叙述正确的有AD.
A.该分子在水中的溶解度大于2-丁烯
B.分子中只有极性键
C.分子中有7个σ键和1个π键
D.该化合物既能发生还原反应又能发生氧化反应
E.分子间可形成氢键
(4)NaF的熔点>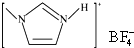 的熔点(填“>”、“=”或“<”),其原因是
的熔点(填“>”、“=”或“<”),其原因是
两者均为离子化合物,且阴阳离子电荷数均为1,但后者的离子半径较大,离子键较弱,因此其熔点较低.
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一.1molNH4BF4含有2mol配位键.
(1)N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:
| 电离能 | I1 | I2 | I3 | I4 | … |
| Ia/kJ•mol-1 | 578 | 1 817 | 2 745 | 11 578 | … |
(2)基态锗(Ge)原子的价层电子排布式是4s24p2.Ge的最高价溴化物分子式是GeBr4.该元素可能的性质或应用有BD.
A.是一种活泼的金属元素 B.其单质可作为半导体材料
C.其元素的电负性大于硫元素 D.其最高价氯化物的沸点低于其溴化物的沸点
(3)关于化合物
 ,下列叙述正确的有AD.
,下列叙述正确的有AD.A.该分子在水中的溶解度大于2-丁烯
B.分子中只有极性键
C.分子中有7个σ键和1个π键
D.该化合物既能发生还原反应又能发生氧化反应
E.分子间可形成氢键
(4)NaF的熔点>
 的熔点(填“>”、“=”或“<”),其原因是
的熔点(填“>”、“=”或“<”),其原因是两者均为离子化合物,且阴阳离子电荷数均为1,但后者的离子半径较大,离子键较弱,因此其熔点较低.
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一.1molNH4BF4含有2mol配位键.
18.将Mg、Cu组成的混合物13.2g投入到适量的稀硝酸中,固体完全溶解,收集到标准状况下的NO气体4.48L(无其他还原产物),向反应后的溶液中加入过量的2.5mol•L-1的NaOH溶液300mL,金属离子完全沉淀.则形成沉淀的质量是( )
| A. | 21.6g | B. | 26.8g | C. | 23.4g | D. | 31.9g |
17.下列离子方程式不正确的是( )
| A. | 用稀硫酸除去铜绿:4H++Cu2(OH)2CO3═2Cu2++CO2↑+3H2O | |
| B. | Fe3O4与稀硝酸反应的离子方程式为:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| C. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:2Ba2++NH4++Al3++2SO42-+4OH-═Al(OH)3↓+NH3•H2O+2BaSO4↓ | |
| D. | 少量氢氧化钙溶液与碳酸氢钠溶液混合:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- |
15.能正确表示下列反应的离子方程式的是( )
| A. | NH4HSO3溶于少量的NaOH溶液中:HSO3-+OH-═SO32-+H2O | |
| B. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| C. | 硫化亚铁溶于稀硝酸中:FeS+2H+═Fe2++H2S↑ | |
| D. | 在NaHSO4溶液中滴加Ba(OH)2至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
14.运用化学知识解决生产、生活中的有关问题备受关注.请回答下列问题:
(1)已知水存在如下平衡:H2O?H++OH-△H>0,现欲使平衡向右移动,且所得溶液显碱性,选择方法是B.
A.向水中加入NaHSO4固体 B.向水中加Na2CO3固体
C.加热至100℃[其中c(H+)=1×10-6 mol•L-1]D.向水中加入NH4Cl固体
(2)常温下,浓度均为0.1mol•L-1的下列五种钠盐溶液的pH如下表;
上述盐溶液中的阴离子,结合H+能力最强的是CO32-,根据表中数据,浓度均
为0.01mol•L-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是C(填编号).
A.HCN B.HClOC.CH3COOHD.H2CO3
(3)实验室中常用NaOH来进行洗气和提纯.当400mL 1mol•L-1的NaOH溶液吸收标准状况
下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为C(Na+)>C(CO32-)>C(OH-)>C(HCO3-)>C(H+).
(4)催化反硝化法可用于治理水中硝酸盐的污染.催化反硝化法中,H2能将NO3-还原为N2,25℃时,反应进行10min,溶液的pH由7变为12.
①N2的电子式为 .
.
②上述反应离子方程式为2NO3-+5H2$\frac{\underline{催化剂}}{△}$ N2+2OH-+4H2O,其平均反应速率v(NO3-)为0.001mol?L-1?min-1
③还原过程中可生成中间产物NO2-,写出3种促进NO2-水解的方法加酸,升高温度,加水.
(1)已知水存在如下平衡:H2O?H++OH-△H>0,现欲使平衡向右移动,且所得溶液显碱性,选择方法是B.
A.向水中加入NaHSO4固体 B.向水中加Na2CO3固体
C.加热至100℃[其中c(H+)=1×10-6 mol•L-1]D.向水中加入NH4Cl固体
(2)常温下,浓度均为0.1mol•L-1的下列五种钠盐溶液的pH如下表;
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
为0.01mol•L-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是C(填编号).
A.HCN B.HClOC.CH3COOHD.H2CO3
(3)实验室中常用NaOH来进行洗气和提纯.当400mL 1mol•L-1的NaOH溶液吸收标准状况
下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为C(Na+)>C(CO32-)>C(OH-)>C(HCO3-)>C(H+).
(4)催化反硝化法可用于治理水中硝酸盐的污染.催化反硝化法中,H2能将NO3-还原为N2,25℃时,反应进行10min,溶液的pH由7变为12.
①N2的电子式为
 .
.②上述反应离子方程式为2NO3-+5H2$\frac{\underline{催化剂}}{△}$ N2+2OH-+4H2O,其平均反应速率v(NO3-)为0.001mol?L-1?min-1
③还原过程中可生成中间产物NO2-,写出3种促进NO2-水解的方法加酸,升高温度,加水.
13. 某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
(1)对PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据判断PM2.5的酸碱性为酸性,试样的pH值=4
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ/mol
写出焦炭与水蒸气反应的热化学方程式C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ/mol;
②洗涤含SO2的烟气,以下物质可作洗涤剂的是ab
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化为:
①已知气缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0,若1mol空气含有0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡.测得NO为8×10-4mol.计算该温度下的平衡常数K=4×10-6,汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是温度升高,反应速率加快,平衡右移
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)═2C(s)+O2(g)已知该反应的△H>0,简述该设想能否实现的依据该反应是焓增、熵减的反应.根据△G=△H-T△S,△G>0,不能实现
(4)在汽车尾气系统中装置催化转化器,可有效降低NOX的排放.
①当尾气中空气不足时,NOX在催化转化器中被还原成N2排出.写出NO被CO还原的化学方程式:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$ N2+2CO2.
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOX生成盐.其吸收能力顺序如下:12MgO<2oCaO<38SrO<56BaO.原因是由Mg、Ca、Sr、Ba的质子数可知,它们均处于第ⅡA族,同一主族自上而下,原子半径增大,元素的金属性逐渐增强,金属氧化物对NOX的吸收能力逐渐增强.
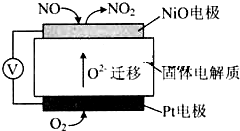
(5)通过NOx传感器可监测NOx的含量,其工作原理示意图如图:
①Pt电极上发生的是还原反应(填“氧化”或“还原”).
②写出NiO电极的电极反应式:NO+O2--2e-=NO2.
 某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:(1)对PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol.L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ/mol
写出焦炭与水蒸气反应的热化学方程式C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ/mol;
②洗涤含SO2的烟气,以下物质可作洗涤剂的是ab
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化为:
①已知气缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0,若1mol空气含有0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡.测得NO为8×10-4mol.计算该温度下的平衡常数K=4×10-6,汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是温度升高,反应速率加快,平衡右移
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)═2C(s)+O2(g)已知该反应的△H>0,简述该设想能否实现的依据该反应是焓增、熵减的反应.根据△G=△H-T△S,△G>0,不能实现
(4)在汽车尾气系统中装置催化转化器,可有效降低NOX的排放.
①当尾气中空气不足时,NOX在催化转化器中被还原成N2排出.写出NO被CO还原的化学方程式:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$ N2+2CO2.
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOX生成盐.其吸收能力顺序如下:12MgO<2oCaO<38SrO<56BaO.原因是由Mg、Ca、Sr、Ba的质子数可知,它们均处于第ⅡA族,同一主族自上而下,原子半径增大,元素的金属性逐渐增强,金属氧化物对NOX的吸收能力逐渐增强.
(5)通过NOx传感器可监测NOx的含量,其工作原理示意图如图:
①Pt电极上发生的是还原反应(填“氧化”或“还原”).
②写出NiO电极的电极反应式:NO+O2--2e-=NO2.
12.运用有关概念判断下列叙述正确的是( )
| A. | 1molH2燃烧放出的热量为H2的燃烧热 | |
| B. | Na2SO3和H2O2的反应为氧化还原反应 | |
| C. | 若某反应的反应物总能量低于生成物总能量,则该反应为放热反应 | |
| D. | BaSO4的水溶液不导电,故BaSO4是弱电解质 |
10.进行简单类推的思维方法不一定都能得到正确结论,因此类推的结论最终要经过实践的检验才能决定其正确与否.下列几种类推结论中正确的是( )
0 169454 169462 169468 169472 169478 169480 169484 169490 169492 169498 169504 169508 169510 169514 169520 169522 169528 169532 169534 169538 169540 169544 169546 169548 169549 169550 169552 169553 169554 169556 169558 169562 169564 169568 169570 169574 169580 169582 169588 169592 169594 169598 169604 169610 169612 169618 169622 169624 169630 169634 169640 169648 203614
| A. | 可电解熔融MgCl2来制取金属镁,也能电解熔融HCl来制取Cl2 | |
| B. | 卤族元素的单质从F2到I2的熔点逐渐升高,则碱金属元素单质从Li到Cs的熔点也逐渐升高 | |
| C. | 第2周期元素氢化物稳定性顺序是HF>H2O>NH3,则第三周期元素氢化物稳定性顺序是HCl>H2S>PH3 | |
| D. | 少量的Cl2通入FeBr2溶液中生成FeCl3和FeBr3,则少量的Cl2通入FeI2 溶液中也生成FeCl3和FeI3 |