题目内容
14.运用化学知识解决生产、生活中的有关问题备受关注.请回答下列问题:(1)已知水存在如下平衡:H2O?H++OH-△H>0,现欲使平衡向右移动,且所得溶液显碱性,选择方法是B.
A.向水中加入NaHSO4固体 B.向水中加Na2CO3固体
C.加热至100℃[其中c(H+)=1×10-6 mol•L-1]D.向水中加入NH4Cl固体
(2)常温下,浓度均为0.1mol•L-1的下列五种钠盐溶液的pH如下表;
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
为0.01mol•L-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是C(填编号).
A.HCN B.HClOC.CH3COOHD.H2CO3
(3)实验室中常用NaOH来进行洗气和提纯.当400mL 1mol•L-1的NaOH溶液吸收标准状况
下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为C(Na+)>C(CO32-)>C(OH-)>C(HCO3-)>C(H+).
(4)催化反硝化法可用于治理水中硝酸盐的污染.催化反硝化法中,H2能将NO3-还原为N2,25℃时,反应进行10min,溶液的pH由7变为12.
①N2的电子式为
 .
.②上述反应离子方程式为2NO3-+5H2$\frac{\underline{催化剂}}{△}$ N2+2OH-+4H2O,其平均反应速率v(NO3-)为0.001mol?L-1?min-1
③还原过程中可生成中间产物NO2-,写出3种促进NO2-水解的方法加酸,升高温度,加水.
分析 (1)使水的电离平衡向右移动的方法有:升高温度、加入含有弱根离子的盐等,如果溶液呈碱性,说明加入的物质和氢离子反应,导致溶液中氢氧根离子浓度大于氢离子浓度而使溶液呈碱性;
(2)越容易水解的盐,越容易结合氢离子,相同浓度的钠盐溶液,pH越大则盐的水解程度越大,浓度相同的酸稀释相同的倍数后,酸性越强的酸其pH变化越大;
(3)根据盐类的水解和电荷守恒来分析,注意盐类的水解是微弱的;
(4)①氮气分子中氮原子间存在3个共用电子对;
②在催化剂条件下,氢气和硝酸根离子发生氧化还原反应生成氮气、水和氢氧根离子;先根据溶液pH的变化计算氢氧根离子反应速率,再根据氢氧根离子和硝酸根离子之间的关系式计算硝酸根离子反应速率;
③亚硝酸根离子水解是吸热反应,根据外界条件对其水解反应影响来分析;
解答 解:(1)A.向水中加入NaHSO4固体,硫酸氢钠溶解后电离出氢离子,抑制水电离,且溶液中C(H+)>C(OH-),溶液呈酸性,故错误;
B.向水中加Na2CO3固体,碳酸钠是强碱弱酸盐能水解,碳酸根离子和氢离子结合生成碳酸氢根离子,从而促进水电离,导致溶液中C(OH-)>C(H+),溶液呈碱性,故正确;
C.水的电离是吸热反应,加热至100℃,促进水电离,溶液C(OH-)=C(H+),溶液呈中性,故错误;
D.向水中加入NH4Cl固体,氯化铵水解,铵根离子和氢氧根离子反应生成一水合氨,从而促进水电离,导致溶液中C(H+)>C(OH-),溶液呈酸性,故错误;
故选B;
(2)越容易水解的盐,越容易结合氢离子,相同浓度的钠盐溶液,pH越大则盐的水解程度越大,所以最易水解的盐是碳酸钠,所以最容易结合氢离子的阴离子是CO32-;浓度相同的酸稀释相同的倍数后,酸性越强的酸其pH变化越大,HCN、HClO、CH3COOH、H2CO3四种酸的酸性大小顺序是CH3COOH>H2CO3>HClO>HCN,所以溶液的pH变化最大的是醋酸,故选C;
故答案为:CO32-;C;
(3)400mL 1mol•L-1的NaOH的物质的量=1mol/L×0.4L=0.4mol,标准状况下4.48LCO2的物质的量=$\frac{4.48L}{22.4L/mol}$=0.2mol,所以氢氧化钠和二氧化碳反应方程式为CO2+2NaOH=Na2CO3+H2O,溶液中碳酸根离子水解而使溶液呈碱性,即C(OH-)>C(H+),溶液中氢氧根离子有两个来源,一个是碳酸根离子水解,一个是碳酸氢根离子水解,碳酸氢根离子只是碳酸根离子水解,所以C(OH-)>C(HCO3-),碳酸根离子水解程度大于水电离出氢离子程度,所以溶液中C(HCO3-)>C(H+),故溶液中各离子浓度大小顺序是C(Na+)>C(CO32-)>C(OH-)>C(HCO3-)>C(H+),
故答案为:C(Na+)>C(CO32-)>C(OH-)>C(HCO3-)>C(H+);
(4)①N2分子中氮原子间通过氮氮三键结合,且每个N原子含有一对孤电子对,因此其电子式为 ,
,
故答案为: ;
;
②利用溶液pH变化可知有OH-生成,再结合原子守恒可写出反应的离子方程式为:
2NO3-+5H2=N2+2OH-+4H2O,利用离子方程式知v(NO3-)=v(OH-)=$\frac{1{0}^{-2}-1{0}^{-7}}{10}$mol/(L•min)=0.001 mol/(L•min),
故答案为:2NO3-+5H2=N2+2OH-+4H2O,0.001;
③亚硝酸盐水解是吸热反应,且水解时生成氢氧根离子,稀释亚硝酸盐溶液能促进其水解,所以要使NO2-水解使溶液中c(OH-)变大,可促进NO2-水解的措施有加热、加水或加酸等,故答案为:加水、升高温度、加酸.
点评 本题考查了离子浓度大小的比较、溶液pH的计算,氧化还原反应、原电池原理,根据元素化合价变化分析解答氧化还原反应,根据图象中微粒变化确定正负极上发生的反应等知识点,离子浓度大小的比较是学习的难点,一般利用电荷守恒、物料守恒和质子守恒来分析解答,题目难度中等.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案| A. | 明矾溶液中加入过量的氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | 铜粉与98.3%的硫酸加热下反应 Cu+4H++SO42-$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO2↑+2H2O | |
| C. | 氯化亚铁溶液中加入硝酸:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ | |
| D. | 澄清石灰水中加入少量的NaHCO3溶液:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- |
(1)N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:
| 电离能 | I1 | I2 | I3 | I4 | … |
| Ia/kJ•mol-1 | 578 | 1 817 | 2 745 | 11 578 | … |
(2)基态锗(Ge)原子的价层电子排布式是4s24p2.Ge的最高价溴化物分子式是GeBr4.该元素可能的性质或应用有BD.
A.是一种活泼的金属元素 B.其单质可作为半导体材料
C.其元素的电负性大于硫元素 D.其最高价氯化物的沸点低于其溴化物的沸点
(3)关于化合物
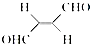 ,下列叙述正确的有AD.
,下列叙述正确的有AD.A.该分子在水中的溶解度大于2-丁烯
B.分子中只有极性键
C.分子中有7个σ键和1个π键
D.该化合物既能发生还原反应又能发生氧化反应
E.分子间可形成氢键
(4)NaF的熔点>
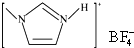 的熔点(填“>”、“=”或“<”),其原因是
的熔点(填“>”、“=”或“<”),其原因是两者均为离子化合物,且阴阳离子电荷数均为1,但后者的离子半径较大,离子键较弱,因此其熔点较低.
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一.1molNH4BF4含有2mol配位键.
| A. | “海市蜃楼”是一种与光学和胶体性质相关的自然现象 | |
| B. | 铁制管道涂铝粉可防锈蚀 | |
| C. | 锂可用于制造质量轻、容电量大的可充电电池 | |
| D. | 焊锡中铅的作用是提高熔点 |
 碳是地球上含量丰富的元素,其氧化物的研究有着重要意义.
碳是地球上含量丰富的元素,其氧化物的研究有着重要意义.



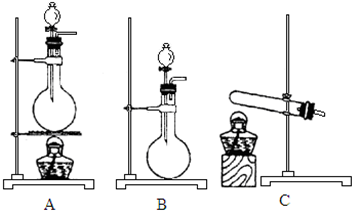
 如图所示,A、B、C是实验室常用的三种制取气体的装置,提供的药品有:大理石、浓盐酸、稀盐酸、锌粒、二氧化锰、氯化铵、熟石灰.现欲利用这些药品分别制取NH3、Cl2、H2、CO2四种气体,试回答下列问题:
如图所示,A、B、C是实验室常用的三种制取气体的装置,提供的药品有:大理石、浓盐酸、稀盐酸、锌粒、二氧化锰、氯化铵、熟石灰.现欲利用这些药品分别制取NH3、Cl2、H2、CO2四种气体,试回答下列问题: