2.硫代硫酸钠俗称保险粉,又名“大苏打”.可用于照相业作定影剂、纸浆漂白作脱氯剂,也可用于氰化物、砷、汞、铅、铋、碘等中毒的治疗,也是一种常用的实验试剂.
Ⅰ.已知:Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O,某研究小组依据该反应探究外界条件对反应速率的影响,设计实验如下:
下列有关说法正确的是AD
A.实验①和②探究其他条件不变时Na2S2O3浓度对相关反应速率的影响
B.实验①和③溶液变浑浊的时间相同
C.其他条件不变时,探究温度对化学反应速率的影响,应选择实验③和⑤
D.该同学在实验中采用的研究方法是实验比较法
Ⅱ.实验室用SO2通入Na2S和Na2CO3的混合溶液中来制备硫代硫酸钠.反应原理为:
2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2
本实验对Na2S纯度要求较高,利用图1所示的装置可将工业级的Na2S提纯.已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精.提纯过程为:将已称量好的工业级Na2S放入圆底烧瓶中,加入一定质量的酒精和少量水.按图1所示装配所需仪器,向冷凝管通入冷却水,同时水浴加热.待烧瓶中固体不再减少时,停止加热.将烧瓶取下,立即趁热过滤,再冷却结晶,过滤.将所得固体洗涤、干燥,得到Na2S•9H2O晶体.
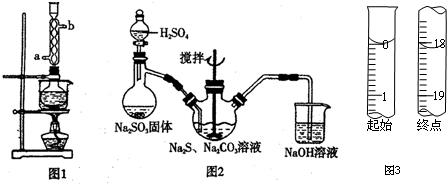
(1)在提纯过程中“趁热过滤”操作的目的是防止硫化钠结晶析出而损失、去除杂质;
(2)用图2所示装置制取Na2S2O3,其中盛放Na2SO3固体的玻璃仪器名称是蒸馏烧瓶,NaOH溶液的作用是吸收SO2等尾气,防止污染.
(3)保险粉样品中Na2S2O3•5H2O的纯度(质量分数)可通过氧化还原滴定法测定,相关反应方程式为2Na2S2O3+I2=2NaI+Na2S4O6.准确称取W g样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂.用0.1000 mol•L?1碘的标准溶液进行滴定.
请回答:
①到达滴定终点的标志滴入最后一滴碘的标准溶液,溶液变为蓝色,且30s内不恢复原色;
②滴定起始和终点的液面位置如图3,则消耗碘的标准溶液体积为18.10mL,产品的纯度为$\frac{0.362M}{W}$%(设Na2S2O3•5H2O相对分子质量为M).
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3•5H2O的纯度的测量结果偏低(填“偏高”、“偏低”或“不变”).
Ⅰ.已知:Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O,某研究小组依据该反应探究外界条件对反应速率的影响,设计实验如下:
| 实验 编号 | 实验温度 /℃ | Na2S2O3 | H2SO4 | 蒸馏水体积 /mL | ||
| 体积/mL | 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | |||
| ① | 25 | 10 | 0.1 | 10 | 0.1 | 0 |
| ② | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| ③ | 25 | 5 | 0.2 | 10 | 0.2 | 5 |
| ④ | 50 | 5 | 0.1 | 10 | 0.1 | 5 |
| ⑤ | 50 | 10 | 0.2 | 5 | 0.2 | 5 |
A.实验①和②探究其他条件不变时Na2S2O3浓度对相关反应速率的影响
B.实验①和③溶液变浑浊的时间相同
C.其他条件不变时,探究温度对化学反应速率的影响,应选择实验③和⑤
D.该同学在实验中采用的研究方法是实验比较法
Ⅱ.实验室用SO2通入Na2S和Na2CO3的混合溶液中来制备硫代硫酸钠.反应原理为:
2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2
本实验对Na2S纯度要求较高,利用图1所示的装置可将工业级的Na2S提纯.已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精.提纯过程为:将已称量好的工业级Na2S放入圆底烧瓶中,加入一定质量的酒精和少量水.按图1所示装配所需仪器,向冷凝管通入冷却水,同时水浴加热.待烧瓶中固体不再减少时,停止加热.将烧瓶取下,立即趁热过滤,再冷却结晶,过滤.将所得固体洗涤、干燥,得到Na2S•9H2O晶体.

(1)在提纯过程中“趁热过滤”操作的目的是防止硫化钠结晶析出而损失、去除杂质;
(2)用图2所示装置制取Na2S2O3,其中盛放Na2SO3固体的玻璃仪器名称是蒸馏烧瓶,NaOH溶液的作用是吸收SO2等尾气,防止污染.
(3)保险粉样品中Na2S2O3•5H2O的纯度(质量分数)可通过氧化还原滴定法测定,相关反应方程式为2Na2S2O3+I2=2NaI+Na2S4O6.准确称取W g样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂.用0.1000 mol•L?1碘的标准溶液进行滴定.
请回答:
①到达滴定终点的标志滴入最后一滴碘的标准溶液,溶液变为蓝色,且30s内不恢复原色;
②滴定起始和终点的液面位置如图3,则消耗碘的标准溶液体积为18.10mL,产品的纯度为$\frac{0.362M}{W}$%(设Na2S2O3•5H2O相对分子质量为M).
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3•5H2O的纯度的测量结果偏低(填“偏高”、“偏低”或“不变”).
1.某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
实验原理2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
实验内容及记录
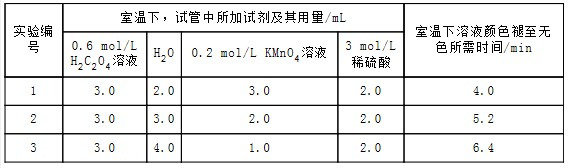
请回答:
(1)根据上表中的实验数据,可以得到的结论是其他条件相同时,增大KMnO4浓度反应速率增大.
(2)利用实验1中数据计算,若用KMnO4的浓度变化表示的反应速率为:υ(KMnO4)=1.5×10-2mol/(L•min).
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示.但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示.该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究.
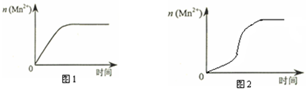
①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用).
②请你帮助该小组同学完成实验方案,并填写表中空白.
③若该小组同学提出的假设成立,应观察到的现象是与实验1比较,溶液褪色所需时间短.
(4)工业上可用电解K2MnO4浓溶液的方法制取KMnO4,则电解时,阳极发生的电极反应为MnO42--e-=MnO4-;总方程式为2K2MnO4+2H2O═2KMnO4+2KOH+H2↑.
实验原理2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
实验内容及记录

请回答:
(1)根据上表中的实验数据,可以得到的结论是其他条件相同时,增大KMnO4浓度反应速率增大.
(2)利用实验1中数据计算,若用KMnO4的浓度变化表示的反应速率为:υ(KMnO4)=1.5×10-2mol/(L•min).
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示.但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示.该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究.
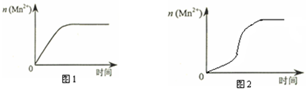
①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用).
②请你帮助该小组同学完成实验方案,并填写表中空白.
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 3 mol/L 稀硫酸 | 0.05 mol/L KMnO4溶液 | |||
| 4 | 3.0 | 2.0 | 2.0 | 3.0 | t | |
(4)工业上可用电解K2MnO4浓溶液的方法制取KMnO4,则电解时,阳极发生的电极反应为MnO42--e-=MnO4-;总方程式为2K2MnO4+2H2O═2KMnO4+2KOH+H2↑.
15.填写下面的表格,从这些数据中得出有用的结论:
结论:当质量以g为单位时,
①1mol任何原子的质量在数值上都等于相对原子质量;
②1mol任何分子的质量在数值上都等于这种分子的相对分子质量;
③1mol任何离子的质量在数值上都等于这种离子的相对原子质量.
| 粒子符号 | 相对分子(原子)质量 | 每个粒子的质量(g/个) | 1mol物质含有的粒子数(个) | 1mol物质质量(g) |
| C | 1.993×10-23 | |||
| Fe | 9.302×10-23 | |||
| H2SO4 | 1.628×10-22 | |||
| H2O | 2.990×10-23 | |||
| Na+ | 3.821×10-23 | |||
| OH- | 2.824×10-23 |
①1mol任何原子的质量在数值上都等于相对原子质量;
②1mol任何分子的质量在数值上都等于这种分子的相对分子质量;
③1mol任何离子的质量在数值上都等于这种离子的相对原子质量.
12.下列物质分类正确的是( )
| A. | FeO、Fe2O3、Na2O2均为碱性氧化物 | B. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | ||
| C. | 烧碱、冰醋酸、四氯化碳均为电解质 | D. | 盐酸、水玻璃、氨水均为混合物 |
11.YBa2Cu8O2(Y为元素钇)是磁悬浮列车中的重要超导材料,下列关于${\;}_{39}^{59}Y$的说法不正确的是( )
0 169206 169214 169220 169224 169230 169232 169236 169242 169244 169250 169256 169260 169262 169266 169272 169274 169280 169284 169286 169290 169292 169296 169298 169300 169301 169302 169304 169305 169306 169308 169310 169314 169316 169320 169322 169326 169332 169334 169340 169344 169346 169350 169356 169362 169364 169370 169374 169376 169382 169386 169392 169400 203614
| A. | 属于金属元素 | |
| B. | 质子数与中子数之差为50 | |
| C. | 原子的核外电子数是39 | |
| D. | ${\;}_{39}^{49}$Y和${\;}_{39}^{50}$Y是两种不同的核素 |
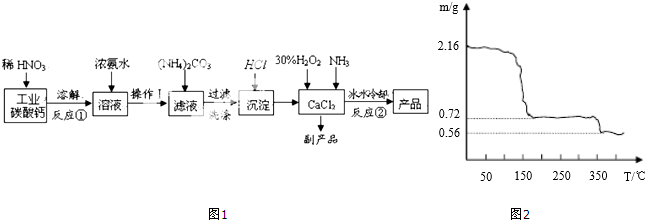
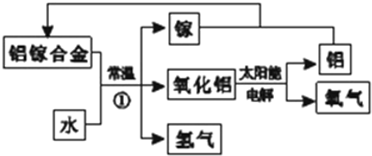 铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中.
铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中.