题目内容
12.下列物质分类正确的是( )| A. | FeO、Fe2O3、Na2O2均为碱性氧化物 | B. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | ||
| C. | 烧碱、冰醋酸、四氯化碳均为电解质 | D. | 盐酸、水玻璃、氨水均为混合物 |
分析 A、碱性氧化物是指和酸反应生成盐和水的氧化物;
B、胶体是分散质直径在1-100nm的分散系,硅酸是沉淀,氯化铁溶液不是胶体;
C、电解质是水溶液中或熔融状态能导电的化合物,四氯化碳是非电解质;
D、不同物质组成的物质为混合物.
解答 解:A、FeO、Fe2O3和酸反应生成盐和水,均为碱性氧化物,过氧化钠和酸反应生成盐和水,还有氧气,不是碱性氧化物,故A错误;
B、稀豆浆属于胶体、硅酸是难溶的沉淀、氯化铁溶液不是胶体,分散质微粒直径不同是分散系的本质区别,故B错误;
C、烧碱是氢氧化钠水溶液中完全电离是强电解质、冰醋酸水溶液中部分电离是弱电解质、四氯化碳水溶液中或熔融状态都不导电属于非电解质,故C错误;
D、盐酸是氯化氢的水溶液属于混合物、水玻璃是硅酸钠水溶液,属于混合物、氨水是氨气溶于水形成的溶液属于混合物,所以均为混合物,故D正确;
故选D.
点评 本题考查了氧化物分类,分散系的区分,电解质的判断,混合物的物质组成,题目较简单.

练习册系列答案
相关题目
3.下列说法正确的是( )
| A. | 冰中每个水分子平均形成两个氢键 | |
| B. | 冰、“可燃冰”、干冰都具有分子密堆积特征 | |
| C. | 分子晶体中一定不存在单个的原子 | |
| D. | “可燃冰”不属于分子晶体 |
7.下列离子方程式书写正确的是( )
| A. | 金属钠投入到水中 Na+2H2O═Na++2OH-+H2↑ | |
| B. | 碳酸氢钠溶液与盐酸反应:HCO3-+H+═CO2↑+H2 O | |
| C. | 强酸与强碱反应:H++OH-═H2O | |
| D. | CaCO3与盐酸反应:CO32-+2H+═CO2↑+H2O |
4.利用如图所示装置进行下列实验,能得出相应实验结论的是( )
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 稀硫酸 | Na2S | AgNO3与AgCl的浊液 | Ksp(AgCl)>Ksp(Ag2S) | |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
| C | 浓硫酸 | Na2SO3 | 品红溶液 | SO2具有漂白性 | |
| D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
5.下列几组判断均正确的是( )
①${\;}_1^1H$和${\;}_1^2H$互为同位素 ② 和
和 为同一物质③
为同一物质③ 和
和 为同分异构体④O2和O3互为同素异形体⑤
为同分异构体④O2和O3互为同素异形体⑤ 和
和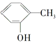 为同系物 ⑥
为同系物 ⑥ 和
和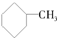 为芳香化合物( )
为芳香化合物( )
①${\;}_1^1H$和${\;}_1^2H$互为同位素 ②
 和
和 为同一物质③
为同一物质③ 和
和 为同分异构体④O2和O3互为同素异形体⑤
为同分异构体④O2和O3互为同素异形体⑤ 和
和 为同系物 ⑥
为同系物 ⑥ 和
和 为芳香化合物( )
为芳香化合物( )| A. | ①③④⑥ | B. | ①②④⑤ | C. | ①②⑤⑥ | D. | ②③④⑤ |
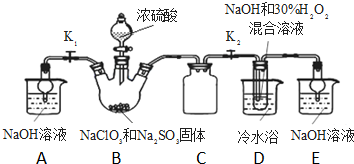 亚氯酸钠(NaClO2)是重要漂白剂.探究小组开展如下实验,回答下列问题:
亚氯酸钠(NaClO2)是重要漂白剂.探究小组开展如下实验,回答下列问题: