题目内容
3.过氧化钙晶体(CaO2•8H2O)可用于改善地表水质、处理含重金属粒子废水、应急供氧等.实验室可用工业碳酸钙(含MgCO3、FeCO3杂质)制取纯净的碳酸钙,然后再用纯净的碳酸钙制取过氧化钙晶体,其主要流程如图1: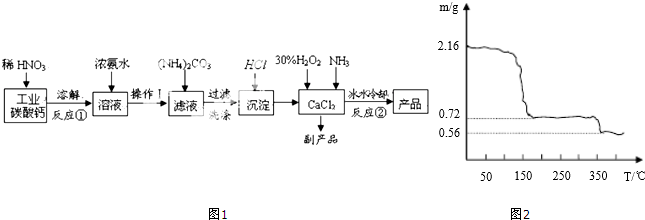
回答下列问题:
(1)写出反应①发生氧化还原反应的离子方程式3FeCO3+10H++NO3-=3Fe3++NO↑+3CO2↑+5H2O.操作I用的玻璃仪器有漏斗、烧杯、玻璃棒.
(2)反应②生成CaO2•8H2O的化学反应方程式为CaCl2+H2O2+2NH3+8H2O=CaO2•8H2O+2NH4Cl;反应②冰水控制温度在0℃左右的主要原因是防止H2O2分解,提高其利用率或降低CaO2•8H2O溶解度,提高产率;
(3)已知:I2+2S2O32-=2I-+S4O62-,测定产品中CaO2的含量的实验步骤如下:
第一步:准确称取ag产品放入锥形瓶中,再加入过量的b gKI晶体,加入适量蒸馏水溶解再滴入少量2mol.L-1的H2SO4溶液,充分反应.
第二步:向上述锥形瓶中加入几滴淀粉溶液.m/g
第三步:逐滴加入浓度为c mol.L-1的Na2S2O3溶液发生反应,滴定达到终点时出现的现象是溶液由蓝色变成无色,且30s内不出现蓝色.
若滴定消耗Na2S2O3溶液VmL,样品中CaO2的质量分数为$\frac{3.6cV}{a}$%(用字母表示).
(4)已知过氧化钙加热至350℃左右开始分解放出氧气.将过氧化钙晶体( CaO2•8H2O)在坩埚中加热逐
渐升高温度,测得样品质量随温度的变化如图2曲线所示,则350℃以上所得固体物质的化学式为CaO.
分析 碳酸钙、碳酸镁与稀硝酸反应生成硝硝酸钙、硝酸镁与二氧化碳,碳酸亚铁与稀硝酸反应生成硝酸铁、二氧化碳、NO,溶液中加入浓氨水,镁离子、铁离子转化为氢氧化镁、氢氧化铁沉淀,过滤除去,滤液中加入碳酸铵将硝酸钙转化为碳酸钙,过滤分离得到碳酸钙,再与盐酸反应生成氯化钙,在加入过氧化氢、氨气得到反应得到CaO2,溶液冷却结晶得到CaO2•8H2O,副产品中含有氯化铵.
(1)反应①中只有FeCO3与硝酸反应是氧化还原反应;操作I是过滤;
(2)该反应的反应物为CaCl2、H2O2、NH3,反应生成CaO2•8H2O与NH4Cl;
H2O2受热易分解,采用冰水控制温度在0℃左右,防止其分解,提高利用率,同时温度低能较低溶解度,提高产率;
(3)碘遇淀粉变蓝色,结束时溶液由蓝色变成无色;
根据电子转移守恒及题中反应方程式,可得关系式:CaO2~I2~2S2O32-,设样品中CaO2的质量分数为x,根据关系式列方程计算;
(4)固体由2.16g加热到350℃变为0.56g,在加热过程中固体中钙元素的量不变,据此计算剩余固体中Ca元素质量,利用质量守恒计算剩余固体中O元素质量,进而确定化学式.
解答 解:碳酸钙、碳酸镁与稀硝酸反应生成硝硝酸钙、硝酸镁与二氧化碳,碳酸亚铁与稀硝酸反应生成硝酸铁、二氧化碳、NO,溶液中加入浓氨水,镁离子、铁离子转化为氢氧化镁、氢氧化铁沉淀,过滤除去,滤液中加入碳酸铵将硝酸钙转化为碳酸钙,过滤分离得到碳酸钙,再与盐酸反应生成氯化钙,在加入过氧化氢、氨气得到反应得到CaO2,溶液冷却结晶得到CaO2•8H2O,副产品中含有氯化铵.
(1)反应①中只有FeCO3与硝酸反应是氧化还原反应,反应方程式为:3FeCO3+10H++NO3-=3Fe3++NO↑+3CO2↑+5H2O;操作I是过滤,需要的玻璃仪器有:漏斗、烧杯、玻璃棒,
故答案为:3FeCO3+10H++NO3-=3Fe3++NO↑+3CO2↑+5H2O;漏斗、烧杯、玻璃棒;
(2)该反应的反应物为CaCl2、H2O2、NH3,反应生成CaO2•8H2O与NH4Cl,反应方程式为:CaCl2+H2O2+2NH3+8H2O=CaO2•8H2O+2NH4Cl;
H2O2受热易分解,采用冰水控制温度在0℃左右,防止其分解,提高利用率,同时温度低能较低溶解度,提高产率,
故答案为:CaCl2+H2O2+2NH3+8H2O=CaO2•8H2O+2NH4Cl;防止H2O2分解,提高其利用率或降低CaO2•8H2O溶解度,提高产率;
(3)碘遇淀粉变蓝色,滴入最后一滴Na2S2O3溶液,溶液由蓝色变成无色,且30s内不出现蓝色,说明滴定到达终点;
根据电子转移守恒及题中反应方程式,可得关系式:CaO2~I2~2S2O32-,设样品中CaO2的质量分数为x,则:CaO2~I2~2S2O32-,
72g 2mol
ax g V×10-3L×c mol.L-1
所以72g:ax g=2mol:V×10-3L×c mol.L-1
解得x=$\frac{3.6cV}{a}$%,
故答案为:溶液由蓝色变成无色,且30s内不出现蓝色;$\frac{3.6cV}{a}$%;
(4)固体由2.16g加热到350℃变为0.56g,在加热过程中固体中钙元素的量不变,剩余固体中n(Ca)=n(CaO2•8H2O)=$\frac{2.16g}{216g/mol}$=0.01mol,m(Ca)=0.01mol×40g/mol=0.4g,则剩余固体中m(O)=0.56g-0.4g=0.16mol,故n(O)=$\frac{0.16mol}{16g/mol}$=0.01mol,故n(Ca):n(O)=1:1,剩余固体的化学式为CaO,
故答案为:CaO.
点评 本题考查化实验制备化工流程、反应原理、氧化还原反应滴定应用、有关图象的计算等有关问题,是对学生综合能力的考查,难度中等.

 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案| A. | 2mol/LH2SO4溶液 | B. | 2mol/LNaOH溶液 | ||
| C. | 2mol/LMgSO4溶液 | D. | 硅酸溶胶(胶体粒子带负电荷) |
| A. | 氢氧化钡溶液与硫酸反应 Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| B. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+=Ca2++2H2O | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag | |
| D. | 碳酸钡溶于稀盐酸中 BaCO3+2H+=Ba2++H2O+CO2↑ |
| 粒子符号 | 相对分子(原子)质量 | 每个粒子的质量(g/个) | 1mol物质含有的粒子数(个) | 1mol物质质量(g) |
| C | 1.993×10-23 | |||
| Fe | 9.302×10-23 | |||
| H2SO4 | 1.628×10-22 | |||
| H2O | 2.990×10-23 | |||
| Na+ | 3.821×10-23 | |||
| OH- | 2.824×10-23 |
①1mol任何原子的质量在数值上都等于相对原子质量;
②1mol任何分子的质量在数值上都等于这种分子的相对分子质量;
③1mol任何离子的质量在数值上都等于这种离子的相对原子质量.
| A. | 在空气中燃烧的生成物都是过氧化物 | |
| B. | 与水反应时都能生成碱和氢气 | |
| C. | 单质的熔沸点随原子序数增加而降低 | |
| D. | 单质的还原性随原子电子层数的增加而增强 |
| A. | Na2O | B. | NaOH | C. | BaCl2 | D. | CH4 |
| A. | 植物油不能使溴水褪色 | B. | 淀粉水解的最终产物是葡萄糖 | ||
| C. | 葡萄糖、蔗糖都能水解 | D. | 油脂从分类上说属于不饱和烃 |