题目内容
13. 铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中.
铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中.(1)铝粉和铁的氧化物(FeO•Fe2O3)可配成铝热剂用于焊接钢轨,反应的化学方程式是8Al+3FeO•Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$4Al2O3+9Fe.
(2)NaOH溶液可以除去铝表面的氧化膜,在处理过程中常会产生H2,产生H2的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)工业上铝土矿(Al2O3•H2O)为原料生产铝,主要包括下列过程:
i.将粉粹、筛选后的铝土矿溶解在NaOH溶液中;
ii.加入过量的试剂A使所得溶液中析出Al(OH)3固体;
iii.使Al(OH)3脱水生成Al2O3;
iv.电解熔融Al2O3生成Al.
铝土矿粉粹的目的是增大接触面积,加快反应速率,试剂A的化学式是CO2.
电解熔融Al2O3时,加入冰晶石,其作用是降低反应混合物熔点,节约能源.
(4)明矾化学式为KAl(SO4)2•12H2O,向明矾溶液中加入Ba(OH)2溶液,当溶液中的SO42-恰好沉淀时,铝元素的存在形式是AlO2-.
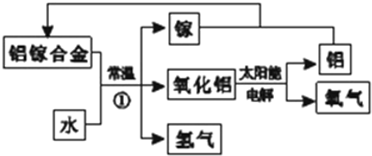
(5)美国普度大学研究开发出一种利用铝镓(镓:Ga)合金制取氢气的新工艺(如图所示).
i.写出常温下铝镓合金产生氢气的化学方程式2AlGa+3H2O=Al2O3+2Ga+3H2↑.
ii.下列有关该工艺的说正确的是BCD.
A.该过程中,能量的转化形式只有两种
B.铝镓合金可以循环使用
C.铝镓合金的熔点比金属铝低
D.该工艺可利用太阳能分解水.
分析 (1)铝热反应实质是铝粉和铁的氧化物发生氧化还原反应生成铁和氧化铝;
(2)铝和氢氧化钠溶液反应生成偏氯酸钠和氢气;
(3)铝土矿粉粹是增大固体与溶液接触面积,加快反应速率,氧化铝溶于氢氧化钠溶液反应生成偏氯酸钠,加入过量的试剂A使所得溶液中析出Al(OH)3固体,碳酸酸性大于氢氧化铝,说明是通入二氧化碳生成;电解熔融Al2O3时,氧化铝熔点高耗能高,加入冰晶石会降低反应物熔点分析;
(4)设明矾KAl(SO4)2•12H2O为1mol,则溶液中含有1molK+、1molAl3+、2molSO42-,根据反应:SO42-+Ba2+═BaSO4↓,当溶液中的SO42-完全沉淀时,需要2molBa2+,即2molBa(OH)2,2molBa(OH)2中含有4molOH-,1molAl3+和4molOH-发生反应:Al3++4OH-═AlO2-+2H2O;铝元素的存在形式为:AlO2-;
(5)i、依据转化关系图中物质分析判断,铝镓合金和水反应生成氧化铝、镓和氢气;
ii、A.工艺流程中,太阳能转化为电能、电能转化为化学能、化学能转变为热能;
B.前边操作中用的物质,在后续操作中又得到该物质,则该物质就可循环使用;
C、合金熔点低于各成分;
D、根据反应物与最终产物,据此整个过程实质是水分解生成氢气与氧气,该工艺中总反应为:2H2O=H2↑+O2↑;
解答 解:(1)铝粉和铁的氧化物(FeO•Fe2O3)可配成铝热剂用于焊接钢轨,铝粉和铁的氧化物发生氧化还原反应生成铁和氧化铝,反应的化学方程式为
8Al+3FeO•Fe2O$\frac{\underline{\;\;△\;\;}}{\;}$4Al2O3+9Fe,
故答案为:8Al+3FeO•Fe2O$\frac{\underline{\;\;△\;\;}}{\;}$4Al2O3+9Fe;
(2)NaOH溶液可以除去铝表面的氧化膜,在处理过程中常会产生H2,铝和氢氧化钠溶液反应生成偏氯酸钠和氢气,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)铝土矿粉粹是增大固体与溶液接触面积,加快反应速率,氧化铝溶于氢氧化钠溶液反应生成偏氯酸钠,加入过量的试剂A使所得溶液中析出Al(OH)3固体,碳酸酸性大于氢氧化铝,说明是通入二氧化碳生成;电解熔融Al2O3时,氧化铝熔点高耗能高,加入冰晶石会降低反应物熔点,节约能源,
故答案为:增大接触面积,加快反应速率,CO2,降低反应混合物熔点,节约能源;
(4)设明矾KAl(SO4)2•12H2O为1mol,则溶液中含有1molK+、1molAl3+、2molSO42-,根据反应:SO42-+Ba2+═BaSO4↓,当溶液中的SO42-完全沉淀时,需要2molBa2+,即2molBa(OH)2,2molBa(OH)2中含有4molOH-,1molAl3+和4molOH-发生反应:Al3++4OH-═AlO2-+2H2O;
铝元素的存在形式为:AlO2-.
故答案为:AlO2-;
(5)i、依据转化关系图中物质分析判断,铝镓合金和水反应生成氧化铝、镓和氢气,反应的化学方程式为:2AlGa+3H2O=Al2O3+2Ga+3H2↑,
故答案为:2AlGa+3H2O=Al2O3+2Ga+3H2↑;
ii、A.工艺流程中,太阳能转化为电能、电能转化为化学能、化学能转变为热能,该过程中,能量的转化形式不只有两种,故A错误;
B.前边操作中用的物质,在后续操作中又得到该物质,则该物质就可循环使用,转化关系中铝镓合金反应最后生成可以循环使用,故B正确;
C、合金熔点低于各成分,铝镓合金的熔点比金属铝低,故C正确;
D、根据反应物与最终产物,据此整个过程实质是水分解生成氢气与氧气,该工艺中总反应为:2H2O=H2↑+O2↑D正确,该工艺可利用太阳能分解水,故D正确,故选BCD.
故答案为:2AlGa+3H2O=Al2O3+2Ga+3H2↑,BCD.
点评 本题考查了镁铝性质的分析判断,物质反应产物判断,流程分析应用,掌握基础是解题关键,题目难度中等.

 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案| A. | 金属晶体和离子晶体都能导电 | |
| B. | 在镁晶体中,1个Mg2+只与2个价电子存在强烈的相互作用 | |
| C. | 金属晶体和离子晶体都可采取“紧密堆积”方式,原子晶体都可采取“非紧密堆积”方式 | |
| D. | 金属晶体和离子晶体中分别存在金属键和离子键等相互作用,很难断裂,因而都具有延展性 |
| A. | 悬浊液 | B. | 乳浊液 | C. | 胶体 | D. | 溶液 |
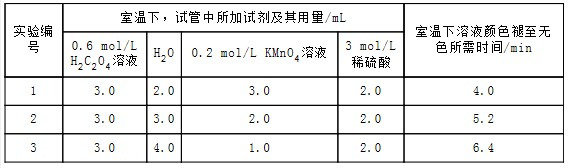
实验原理2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
实验内容及记录
请回答:
(1)根据上表中的实验数据,可以得到的结论是其他条件相同时,增大KMnO4浓度反应速率增大.
(2)利用实验1中数据计算,若用KMnO4的浓度变化表示的反应速率为:υ(KMnO4)=1.5×10-2mol/(L•min).
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示.但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示.该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究.
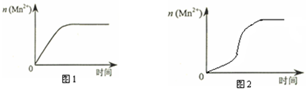
①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用).
②请你帮助该小组同学完成实验方案,并填写表中空白.
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 3 mol/L 稀硫酸 | 0.05 mol/L KMnO4溶液 | |||
| 4 | 3.0 | 2.0 | 2.0 | 3.0 | t | |
(4)工业上可用电解K2MnO4浓溶液的方法制取KMnO4,则电解时,阳极发生的电极反应为MnO42--e-=MnO4-;总方程式为2K2MnO4+2H2O═2KMnO4+2KOH+H2↑.
| A. | 在空气中燃烧的生成物都是过氧化物 | |
| B. | 与水反应时都能生成碱和氢气 | |
| C. | 单质的熔沸点随原子序数增加而降低 | |
| D. | 单质的还原性随原子电子层数的增加而增强 |
| A. | 在0.1 mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 在0.1 mol•L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) | |
| C. | 常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol•L-1]:c(Na+)>c(CH3COO-)>c(H+)=c(OH-) | |
| D. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1 mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |