5.有关二氧化硫的叙述正确的是( )
| A. | 二氧化硫不能使溴水、高锰酸钾溶液迅速褪色 | |
| B. | 接触法制硫酸的沸腾炉排出的炉气中含SO2 | |
| C. | 实验室可用启普发生器制取二氧化硫 | |
| D. | 用石灰水很容易区分二氧化碳和二氧化硫 |
4.二次电池又叫可逆电池,下列电池不属于二次电池的是( )
| A. | 酸性锌锰干电池和碱性锌锰干电池 | B. | 铅蓄电池 | ||
| C. | 氢气燃料电池和甲烷燃料电池 | D. | 镍镉电池和锂电池 |
3.如图是氢氧燃料电池构造示意图.关于该电池的说法不正确的是( )


| A. | a极是正极 | B. | 电池总反应式为:2H2+O2=2H2O | ||
| C. | 电子由b通过灯泡流向a | D. | 氢氧燃料电池是环保电池 |
2.已知2A(g)+B(g)?2C(g)△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2mol A和1mol B,在500℃时充分反应达平衡后C的浓度为w mol/L,放出热量为b kJ.
(1)下表为不同温度下该反应的平衡常数.由此可推知,表中T1<T2(填“>”“=”或“<”).
若在原来的容器中,只加入2mol C,500℃时充分反应达平衡后,吸收热量为c kJ,C的浓度=(填“>”、“=”或“<”)w mol/L,a、b、c之间满足何种关系a=b+c(用代数式表示).
(2)在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是D.
A.4mol A和2mol B B.4mol A、2mol B和2mol C
C.4mol A和4mol B D.6mol A和4mol B
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出C气体 B.适当升高温度C.增大B的浓度 D.选择高效催化剂
(4)若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A和1mol B,500℃时充分反应达平衡后,放出热量为d kJ,则d>b(填“>”“=”或“<”).
(5)在一定温度下,向一个容积可变的容器中,通入3mol A和2mol B及固体催化剂,使之反应,平衡时容器内气体压强为起始时的90%.保持同一反应温度,在相同容器中,将起始物质的量改为4mol A、3mol B和2mol C,则平衡时A的百分含量不变(填“不变”“变大”“变小”或“无法确定”).
(1)下表为不同温度下该反应的平衡常数.由此可推知,表中T1<T2(填“>”“=”或“<”).
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
(2)在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是D.
A.4mol A和2mol B B.4mol A、2mol B和2mol C
C.4mol A和4mol B D.6mol A和4mol B
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出C气体 B.适当升高温度C.增大B的浓度 D.选择高效催化剂
(4)若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A和1mol B,500℃时充分反应达平衡后,放出热量为d kJ,则d>b(填“>”“=”或“<”).
(5)在一定温度下,向一个容积可变的容器中,通入3mol A和2mol B及固体催化剂,使之反应,平衡时容器内气体压强为起始时的90%.保持同一反应温度,在相同容器中,将起始物质的量改为4mol A、3mol B和2mol C,则平衡时A的百分含量不变(填“不变”“变大”“变小”或“无法确定”).
1.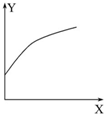 在密闭的容积可变的容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)?2C(g)△H<0.达到平衡后,改变一个条件,下列量(Y)的变化不符合图中曲线的是( )
在密闭的容积可变的容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)?2C(g)△H<0.达到平衡后,改变一个条件,下列量(Y)的变化不符合图中曲线的是( )
 在密闭的容积可变的容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)?2C(g)△H<0.达到平衡后,改变一个条件,下列量(Y)的变化不符合图中曲线的是( )
在密闭的容积可变的容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)?2C(g)△H<0.达到平衡后,改变一个条件,下列量(Y)的变化不符合图中曲线的是( )| X | Y | |
| A | 再加入A | B的转化率 |
| B | 降低温度 | 混合气体的密度 |
| C | 增大压强 | A的转化率 |
| D | 升高温度 | 混合气体的平均摩尔质量 |
| A. | A | B. | B | C. | C | D. | D |
20.温度为T0时,在恒容的密闭容器中发生反应,各物质的浓度随时间变化的关系如图a所示.其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示.下列叙述正确的是( )
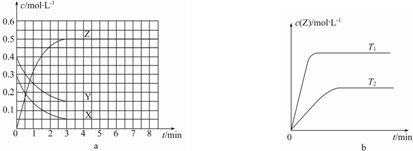

| A. | 该反应的正反应是放热反应 | |
| B. | 若在第6 min时升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| C. | 图a中反应达到平衡时,Y的转化率为37.5% | |
| D. | 反应中某时刻各物质的正反应速率为2v(X)═2v(Y)═v(Z) |
19.下列图象分别表示有关反应的反应过程与能量变化的关系,据此判断下列说法中正确的是( )
| A. | 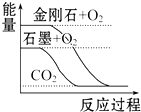 石墨转变为金刚石是吸热反应 | |
| B. | 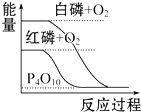 白磷比红磷稳定 | |
| C. | 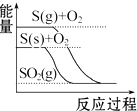 S(g)+O2(g)═SO2(g)△H1 S(s)+O2(g)═SO2(g)△H2 则△H1>△H2 | |
| D. | 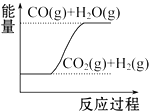 CO(g)+H2O(g)═CO2(g)+H2(g)△H1>0 |
18.已知:H2(g)+F2(g)═2HF(g)△H=-546.6kJ•mol-1,下列说法中不正确的是( )
| A. | 44.8 L氟化氢气体分解成22.4 L的氢气和22.4 L的氟气吸收546.6 kJ热量 | |
| B. | 1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量大于546.6 kJ | |
| C. | 相同条件下,1 mol氢气与1 mol氟气的能量总和高于2 mol氟化氢气体的能量 | |
| D. | 2 mol H-F键的键能比1 mol H-H键和1 mol F-F 键的键能之和大546.6 kJ |
17.下列有关叙述正确的是( )
| A. | 元素的化学性质随着相对原子质量的递增而呈周期性变化 | |
| B. | 元素周期律的实质是因为元素原子最外层电子数由1→8周期性变化而引起的 | |
| C. | 半径由大到小、氧化性由弱到强的是K+、Mg2+、Al3+、H+,而还原性由弱到强的则是I-、Br-、Cl-、F- | |
| D. | 某元素R的最高价氧化物化学式为R2O5,又知R的气态氢化物中含氢的质量分数为8.8%,则R的相对原子质量为28 |
16.J、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如表所示.已知J元素最低负化合价的绝对值与其原子最外层电子数相等,M是地壳中含量最多的金属元素.下列说法错误的是( )
0 169174 169182 169188 169192 169198 169200 169204 169210 169212 169218 169224 169228 169230 169234 169240 169242 169248 169252 169254 169258 169260 169264 169266 169268 169269 169270 169272 169273 169274 169276 169278 169282 169284 169288 169290 169294 169300 169302 169308 169312 169314 169318 169324 169330 169332 169338 169342 169344 169350 169354 169360 169368 203614
| J | ||
| R |
| A. | M和T组成的化合物是共价化合物 | |
| B. | M单质能与氢氧化钠溶液反应,产生一种可燃性气体 | |
| C. | R、T两元素的气态氢化物中,R的气态氢化物更稳定 | |
| D. | J、M、R、T元素最高价氧化物对应的水化物中酸性最强的是HTO4 |