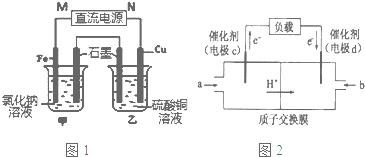
10.(1)用分液漏斗、锥形瓶、导管、注射器、双孔胶塞、秒表和铁架台可以(选填“可以”、“不可以”)测定锌和稀硫酸反应生成氢气的反应速率
(2)为证明盐的水解是吸热反应,四位学生分别设计了如下实验方案,其中正确的是甲乙
甲.在醋酸钠溶液中滴入2滴酚酞,加热后红色加深,说明盐类水解是吸热反应
乙.用等浓度纯碱溶液去油污,热溶液比冷溶液效果好,说明盐类水解是吸热反应
丙.将硝酸铵晶体溶于水,水温下降,说明盐类水解是吸热反应
丁.在氨水中加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热反应
(3)用标准NaOH溶液滴定未知浓度的盐酸溶液,下列操作造成测定结果偏高的是BC
A.酸式滴定管用蒸馏水洗净后,未用待测盐酸润洗
B.滴定前,碱式滴定管尖嘴有气泡,滴定后气泡消失
C.滴定终点读数时,仰视定管刻度,其他操作正确
(4)用物质的量浓度为0.1000mol/L的KMnO4(H+)溶液滴定未知浓度的H2C2O4(弱酸)溶液,分别取20.00mL 草酸溶液于3个洁净的锥形瓶,用标准的KMnO4(H+)溶液滴定至终点,数据如表:
已知:相关反应方程式为:5H2C2O4+2KMnO4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
请回答下列问题:
①标准KMnO4溶液应装在酸式(选填“酸式”或“碱式”)滴定管中;
②判断已达滴定终点的现象是:当滴下最后一滴标准溶液,溶液由无色变为浅紫色,且在30秒内不褪去;
③实验测得草酸溶液的物质的量浓度为0.2500mol/L.(保留四位有效数字)
(2)为证明盐的水解是吸热反应,四位学生分别设计了如下实验方案,其中正确的是甲乙
甲.在醋酸钠溶液中滴入2滴酚酞,加热后红色加深,说明盐类水解是吸热反应
乙.用等浓度纯碱溶液去油污,热溶液比冷溶液效果好,说明盐类水解是吸热反应
丙.将硝酸铵晶体溶于水,水温下降,说明盐类水解是吸热反应
丁.在氨水中加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热反应
(3)用标准NaOH溶液滴定未知浓度的盐酸溶液,下列操作造成测定结果偏高的是BC
A.酸式滴定管用蒸馏水洗净后,未用待测盐酸润洗
B.滴定前,碱式滴定管尖嘴有气泡,滴定后气泡消失
C.滴定终点读数时,仰视定管刻度,其他操作正确
(4)用物质的量浓度为0.1000mol/L的KMnO4(H+)溶液滴定未知浓度的H2C2O4(弱酸)溶液,分别取20.00mL 草酸溶液于3个洁净的锥形瓶,用标准的KMnO4(H+)溶液滴定至终点,数据如表:
| 测定次数 | 第一次 | 第二次 | 第三次 |
| 初始读数(mL) | 0.40 | 0.90 | 0.00 |
| 终点读数(mL) | 25.05 | 21.00 | 19.90 |
请回答下列问题:
①标准KMnO4溶液应装在酸式(选填“酸式”或“碱式”)滴定管中;
②判断已达滴定终点的现象是:当滴下最后一滴标准溶液,溶液由无色变为浅紫色,且在30秒内不褪去;
③实验测得草酸溶液的物质的量浓度为0.2500mol/L.(保留四位有效数字)
9.合成氨是人类科学技术上的一项重大突破,其反应原理为
N2(g)+3H2(g)═2ΝΗ3(g)△H=-92.4kJ•mol-1.
(1)T℃时在2L的密闭容器中,N2、H2混合气体充分反应5min后放出热量46.2kJ,
用H2表示的平均速率为0.15molL-1min-1或0.15mol/(Lmin).
(2)合成氨厂可用反应CO(g)+H2O(g)?H2(g)+CO2(g)获得H2,已知该反应的平衡
常数随温度的变化如表,试回答下列问题:
①在800℃发生上述反应,向恒容反应器投入CO2、H2、CO、H2O的物质的量分别为:1mol、1mol、2mol、2mol,此时该反应由正反应方向开始建立平衡.
(选填“正”或“逆”).
②在500℃时进行上述反应,若CO、H2O的起始浓度均为0.020mol•L-1,在该条件下,CO的最大转化率为75%.
③在其他条件不变的前提下,下列措施一定可以提高H2的百分含量的有d;
a.增加CO的用量 b.增加H2O(g)的用量c.增大压强 d.降低温度.
N2(g)+3H2(g)═2ΝΗ3(g)△H=-92.4kJ•mol-1.
(1)T℃时在2L的密闭容器中,N2、H2混合气体充分反应5min后放出热量46.2kJ,
用H2表示的平均速率为0.15molL-1min-1或0.15mol/(Lmin).
(2)合成氨厂可用反应CO(g)+H2O(g)?H2(g)+CO2(g)获得H2,已知该反应的平衡
常数随温度的变化如表,试回答下列问题:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(选填“正”或“逆”).
②在500℃时进行上述反应,若CO、H2O的起始浓度均为0.020mol•L-1,在该条件下,CO的最大转化率为75%.
③在其他条件不变的前提下,下列措施一定可以提高H2的百分含量的有d;
a.增加CO的用量 b.增加H2O(g)的用量c.增大压强 d.降低温度.
6.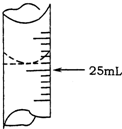 欲测定某NaOH溶液的物质的量浓度,可用0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).
欲测定某NaOH溶液的物质的量浓度,可用0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).
请回答下列问题:
(1)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10mL,滴定后液面如图,则此时消耗标准溶液的体积为23.80mL;
(2)乙学生做了三组平行实验,数据记录如下:
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为0.1044mol•L-1(小数点后保留四位);
(3)下列哪些操作会使测定结果偏高AC(填序号).
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数.
 欲测定某NaOH溶液的物质的量浓度,可用0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).
欲测定某NaOH溶液的物质的量浓度,可用0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).请回答下列问题:
(1)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10mL,滴定后液面如图,则此时消耗标准溶液的体积为23.80mL;
(2)乙学生做了三组平行实验,数据记录如下:
| 实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol•L-1HCl溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.11 |
| 2 | 25.00 | 1.56 | 31.30 |
| 3 | 25.00 | 0.22 | 26.31 |
(3)下列哪些操作会使测定结果偏高AC(填序号).
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数.
5.生活中的一些问题常涉及化学知识.下列叙述中,正确的是( )
| A. | 甲型H1N1流感病毒是一种油脂 | |
| B. | 我们所吃的豆腐中主要含有蛋白质 | |
| C. | 棉花和蚕丝的主要成分都是纤维素 | |
| D. | 糯米中的淀粉一经发生水解反应就酿造成酒 |
4.下列关于常见化学物质的应用不正确的是( )
| A. | 过氧化钠能用作供氧剂 | |
| B. | 氯化钠可用作净水剂 | |
| C. | 味精可用作食品添加剂 | |
| D. | 小苏打是一种膨松剂,可用于制作馒头和面包 |
3.下列说法正确的是( )
| A. | 含有共价键的物质一定是共价化合物 | |
| B. | 分子中只有共价键的化合物一定是共价化合物 | |
| C. | 离子化合物中一定没有共价键 | |
| D. | 离子化合物一定含有金属元素 |
2.下列各组物质中,化学键类型完全相同的是( )
0 169133 169141 169147 169151 169157 169159 169163 169169 169171 169177 169183 169187 169189 169193 169199 169201 169207 169211 169213 169217 169219 169223 169225 169227 169228 169229 169231 169232 169233 169235 169237 169241 169243 169247 169249 169253 169259 169261 169267 169271 169273 169277 169283 169289 169291 169297 169301 169303 169309 169313 169319 169327 203614
| A. | SO2和NaOH | B. | CO2和H2O | C. | Cl2和O3 | D. | CCl4和KCl |