题目内容
3.下列说法正确的是( )| A. | 含有共价键的物质一定是共价化合物 | |
| B. | 分子中只有共价键的化合物一定是共价化合物 | |
| C. | 离子化合物中一定没有共价键 | |
| D. | 离子化合物一定含有金属元素 |
分析 只含有共价键的化合物属于共价化合物,含有离子键的化合物属于离子化合物,共价化合物中一定没有离子键,离子化合物中可能含有共价键,据此分析.
解答 解:A.只含有共价键的化合物属于共价化合物,含有共价键的物质可能是离子化合物,如NaOH中含有离子键和共价键,属于离子化合物,故A错误;
B.共价化合物中不同原子间以共用电子对形成化学键,共价化合物中只含共价键,故B正确;
C.离子化合物中一定含有离子键,可能含有共价键,如NaOH中含有离子键和共价键,为离子化合物,故C错误;
D.离子化合物中不一定含有金属元素,如氯化铵中含有离子键,属于离子化合物,但是氯化铵中只含有非金属元素,故D错误.
故选B.
点评 本题考查化学键及化合物的类别,熟悉化学键的形成及特殊物质中的化学键即可解答,注意利用实例来分析解答,题目难度不大.

练习册系列答案
相关题目
13.国际化学年的主题是“化学--我们的生活,我们的未来”.下列做法不正确的是( )
| A. | 利用露天焚烧方法处理塑料废弃物 | |
| B. | 利用高纯单质硅制成太阳能电池 | |
| C. | 利用微生物发酵技术,将植物秸秆、动物粪便等制成沼气 | |
| D. | 利用二氧化碳等原料合成聚碳酸酯类可降解塑料代替聚乙烯塑料 |
14.NM-3和D-58是正处于临床试验阶段的小分子抗癌药物,结构如下:关于NM-3和D-58的叙述,错误的是( )


| A. | 都能与NaOH溶液反应,每mol消耗NaOH的物质的量之比为1:1 | |
| B. | 都能与溴水反应,每mol消耗Br2的物质的量之比为3:2 | |
| C. | 都能与H2发生加成反应,每mol消耗H2的物质的量之比为4:7 | |
| D. | 都能与O2发生氧化反应,每mol消耗O2的物质的量之比为13:15 |
11.设NA为阿伏加德罗常数的数值,下列说法错误的是( )
| A. | 一定条件下,2 mol SO2和1 mol O2混合在密闭容器中充分反应后容器中的分子数大于2NA | |
| B. | 256 g S8分子中含S-S键为7NA个.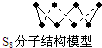 | |
| C. | 由1 mol CH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个 | |
| D. | 1 mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数为NA个 |
15.硅在地壳中的含量较高.硅及其化合物的开发由来已久,在现代生活中有广泛用于,回答下列问题:
(1)网络与人们的生活密切相关,传导网络数据的光导纤维的主要成方的化学式是SiO2.
(2)陶瓷、水泥和玻璃是常用的硅酸盐材料,其中,生产普通玻璃的主要原料有石英砂、纯碱、石灰石.
(3)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料.工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
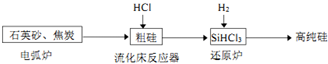
①石英砂和焦炭在电弧炉中高温加热生产粗碳反应的化学方程式为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si(粗硅)+2CO↑.
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,则流化床主要发生反应的化学反应方程式为2Si(粗硅)+6HCl=2SiHCl3+2H2↑.产物中分子结构为正四面体的物质的名称为四氯化硅或四氯硅烷.
③有关物质的沸点数据如下表.
提纯SiHCl3的主要工艺操作依次是沉降、冷凝和精馏,SiHCl3极易水解,其完全水解的所有产物为H4SiO4(或H2SiO3)、H2、HCl.
(1)网络与人们的生活密切相关,传导网络数据的光导纤维的主要成方的化学式是SiO2.
(2)陶瓷、水泥和玻璃是常用的硅酸盐材料,其中,生产普通玻璃的主要原料有石英砂、纯碱、石灰石.
(3)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料.工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:

①石英砂和焦炭在电弧炉中高温加热生产粗碳反应的化学方程式为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si(粗硅)+2CO↑.
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,则流化床主要发生反应的化学反应方程式为2Si(粗硅)+6HCl=2SiHCl3+2H2↑.产物中分子结构为正四面体的物质的名称为四氯化硅或四氯硅烷.
③有关物质的沸点数据如下表.
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
12.下列反应的离子方程式正确的是( )
| A. | 氯气跟烧碱溶液反应:Cl2+OH-═Cl-+HClO | |
| B. | 漂白粉溶液中通入足量的SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| C. | 明矾溶液与氢氧化钡溶液反应,使SO42-恰好完全沉淀:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| D. | 将氯气通入氯化亚铁溶液中:Fe2++Cl2═Fe3++2Cl- |
7.下列说法正确的是( )
| A. | 放热反应均是自发反应 | |
| B. | 如果△H和△S为均正值,当高温时,反应可能自发进行 | |
| C. | 物质的量增加的反应,△S为正值 | |
| D. | △S为正值的反应均是自发反应 |
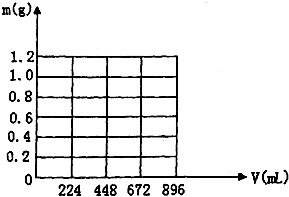 将KOH和Ca(OH)2混合物1.86g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体.当生成沉淀的质量刚好最大时,消耗CO2的体积为224mL(标准状况,忽略CO2溶于水情况,以下情况相同.)
将KOH和Ca(OH)2混合物1.86g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体.当生成沉淀的质量刚好最大时,消耗CO2的体积为224mL(标准状况,忽略CO2溶于水情况,以下情况相同.)