题目内容
9.合成氨是人类科学技术上的一项重大突破,其反应原理为N2(g)+3H2(g)═2ΝΗ3(g)△H=-92.4kJ•mol-1.
(1)T℃时在2L的密闭容器中,N2、H2混合气体充分反应5min后放出热量46.2kJ,
用H2表示的平均速率为0.15molL-1min-1或0.15mol/(Lmin).
(2)合成氨厂可用反应CO(g)+H2O(g)?H2(g)+CO2(g)获得H2,已知该反应的平衡
常数随温度的变化如表,试回答下列问题:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(选填“正”或“逆”).
②在500℃时进行上述反应,若CO、H2O的起始浓度均为0.020mol•L-1,在该条件下,CO的最大转化率为75%.
③在其他条件不变的前提下,下列措施一定可以提高H2的百分含量的有d;
a.增加CO的用量 b.增加H2O(g)的用量c.增大压强 d.降低温度.
分析 (1)3mol氢气完全反应放出92.4kJ热量,则放出热量46.2kJ时消耗氢气物质的量=$\frac{46.2kJ}{92.5kJ}×3mol$=1.5mol,氢气反应速率=$\frac{\frac{△n}{V}}{△t}$;
(2)①该温度下,平衡常数为1,如果浓度商大于平衡常数,则平衡逆向移动,如果等于平衡常数,则平衡不移动,如果小于平衡常数,则平衡正向移动;
②该温度下,平衡常数为9,利用平衡常数计算参加反应的CO浓度,再利用转化率公式计算CO转化率;
③平衡正向移动且不是通过加入反应物时能提高氢气百分含量.
解答 解:(1)3mol氢气完全反应放出92.4kJ热量,则放出热量46.2kJ时消耗氢气物质的量=$\frac{46.2kJ}{92.5kJ}×3mol$=1.5mol,氢气反应速率=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{1.5mol}{2L}}{5min}$=0.15molL-1min-1 或0.15mol/(Lmin),
故答案为:0.15molL-1min-1 或0.15mol/(Lmin);
(2)①该温度下,平衡常数为1,c(CO2)=c(H2)=0.5mol/L、c(CO)=c(H2O)=1mol/L,浓度商=$\frac{0.5×0.5}{1×1}$=0.25<1,则平衡正向移动,故答案为:正;
②温度下,平衡常数为9,设参加反应的CO的物质的量为xmol/L,
CO(g)+H2O(g)?H2(g)+CO2(g)
开始0.02mol/L0.02mol/L 0 0
反应xmol/L xmol/L xmol/L xmol/L
平衡(0.02-x)mol/L(0.02-x)mol/L xmol/L xmol/L
所以平衡常数K=$\frac{x.x}{(0.02-x).(0.02-x)}$=9,x=0.015,
转化率=$\frac{0.015mol/L}{0.02mol/L}$×100%=75%,
故答案为:75%;
③平衡正向移动且不是通过加入反应物时能提高氢气百分含量,
a.增加CO的物质的量,虽然平衡正向移动,但参加反应的CO小于加入的,导致氢气含量降低,故错误;
b.增加水蒸气的物质的量,虽然平衡正向移动,但参加反应的水蒸气小于加入的,导致氢气含量降低,故错误;
c.增大压强平衡不移动,则氢气含量不变,故错误;
d.降低温度,平衡正向移动,则氢气含量增大,故正确;
故选d.
点评 本题考查化学平衡计算,为高频考点,采用三段式法进行分析解答即可,难点是利用平衡常数判断平衡移动方向,题目难度中等.

| A. | 在A溶剂中,甲的酸性大于乙;在B溶剂中,甲的酸性可能小于乙 | |
| B. | HNO3在HClO4中是酸,在H2SO4中可能是碱 | |
| C. | 比较HCl,H2SO4,HClO4,HNO3酸性的强弱,用水肯定不能,用冰醋酸可能可以 | |
| D. | 比较HCN与HAc酸性的强弱,用水肯定可以,用液氨肯定也可以 |
| A. | 取少量样品于试管,加水溶解,通入适量Cl2,再加KSCN溶液,观察现象 | |
| B. | 取少量样品于试管,加水溶解,加入NaOH溶液,露置于空气中,观察现象 | |
| C. | 取少量样品于试管,加水溶解,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸置于试管口,观察试纸颜色的变化 | |
| D. | 取少量样品于试管,加水溶解,加入盐酸后再加入BaCl2溶液观察现象 |
| A. | 过氧化钠能用作供氧剂 | |
| B. | 氯化钠可用作净水剂 | |
| C. | 味精可用作食品添加剂 | |
| D. | 小苏打是一种膨松剂,可用于制作馒头和面包 |
| A. | K+、Cu2+、Cl-、SO42- | B. | Na+、AlO2-、NO3-、CH3COO- | ||
| C. | Na+、NH4+、NO3-、S2- | D. | Na+、Ag+、NO3-、Br- |
| A. | Na2CO3溶液 | B. | 银氨溶液 | C. | 氢硫酸 | D. | Cu(OH)2悬浊液 |
| A. | 2KClO3(s)═2KCl(s)+3O2(g);△H=-78.03kJ•mol-1:△S=494.4 J•mol-1•K-1 | |
| B. | CO(g)═C(s,石墨)+$\frac{1}{2}$O2(g);△H=110.5kJ•mol-1,△S=-89.4 J•mol-1•K-1 | |
| C. | 4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)△H=-444.3kJ•mol-1,△S=-280.1 J•mol-1•K-1 | |
| D. | NH4HCO3(s)+CH3COOH(aq)═CO2(g)+CH3COONH4(aq)+H2O(l);△H=37.30kJ•mol-1,△S=184.0 J•mol-1•K-1 |
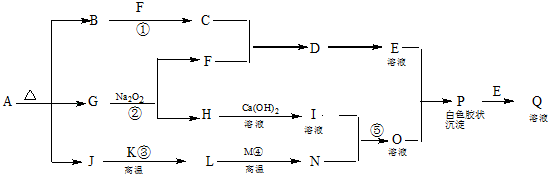
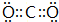 ;
;