题目内容
4.下列关于常见化学物质的应用不正确的是( )| A. | 过氧化钠能用作供氧剂 | |
| B. | 氯化钠可用作净水剂 | |
| C. | 味精可用作食品添加剂 | |
| D. | 小苏打是一种膨松剂,可用于制作馒头和面包 |
分析 A.过氧化钠可与水、二氧化碳反应生成氧气;
B.氯化钠不具有氧化性或吸附性;
C.味精为调味剂;
D.碳酸氢钠俗称小苏打,遇酸放出气体二氧化碳.
解答 解:A.过氧化钠可与二氧化碳等反应生成氧气,可用左供氧剂,故A正确;
B.氯化钠不具有氧化性或吸附性,不能除去水中的杂质,故B错误;
C.味精可用作调味剂,故C正确;
D.制做馒头时面粉先经过发酵,产生大量的酸,加入小苏打与酸反应,既去除发酵过程产生的酸,放出的气体二氧化碳又能使馒头膨胀而松软,另外小苏打不稳定,加热分解也生成二氧化碳气体,故D正确.
故选B.
点评 本题考查了物质是用途,侧重化学与生活的考查,有利于培养学生良好的科学素养,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
14.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | pH=1的溶液中:Fe2+、NO3-、Cl-、Na+ | |
| B. | Na2S溶液中:SO42-、K+、Cl-、Cu2+ | |
| C. | c(H+)=1.0×10-13 mol•L-1溶液中:C6H5O-、K+、SO42-、Br- | |
| D. | 能使甲基橙呈红色的溶液中:Na+、AlO2-、NO3-、HCO3- |
15.下列有关实验的解释或说明正确的是( )
| A. | 为了加快过滤速度,可用减压过滤或边过滤边用玻璃棒搅拌 | |
| B. | 当沉淀的密度较大时,从液体分离出沉淀可用倾析法,它的优点是操作简单,速度快 | |
| C. | 为了减弱铜锌原电池中的极化现象,可在溶液中加入少量的双氧水 | |
| D. | 硝酸银是鉴别食盐和工业盐的最简单的试剂之一 |
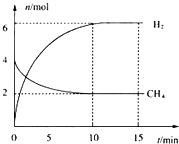
19.以下是关于化学反应2SO2+O2?2SO3的两个素材:
素材1:某温度和压强下,2升容器中,不同时间点测得密闭体系中三种物质的物质的量
素材2:反应在不同条件下进行时SO2的转化率:(SO2的转化率是反应的SO2占起始SO2的百分数,SO2的转化率越大,化学反应的限度越大)
根据以上的两个素材回答问题:
(1)根据素材1中计算20~30s期间,用二氧化硫表示的化学反应平均速率为0.0075mol•L-1•s-1.
(2)根据素材2中分析得到,提高该化学反应限度的途径有增大压强或在一定范围内降低温度.
(3)根据素材1、素材2中分析得到,要实现素材1中SO2的转化率需控制的反应条件是温度为600℃,压强为1MPa.
素材1:某温度和压强下,2升容器中,不同时间点测得密闭体系中三种物质的物质的量
| 时间(s)物质的量(mol)物质 | 0 | 10 | 20 | 30 | 40 | 0 | 60 | 70 |
| SO2 | 1 | 0.7 | 0.5 | 0.35 | 0.2 | 0.1 | 0.1 | 0.1 |
| O2 | 0.5 | 0.35 | 0.25 | 0.18 | 0.1 | 0.05 | 0.05 | 0.05 |
| SO3 | 0 | 0.3 | 0.5 | 0.65 | 0.8 | 0.9 | 0.9 | 0.9 |
| 压强转化率温度 | 0.1MPa | 0.5MPa | 1MPa | 10MPa |
| 400℃ | 99.2 | 99.6 | 99.7 | 99.9 |
| 500℃ | 93.5 | 96.9 | 97.8 | 99.3 |
| 600℃ | 73.7 | 85.8 | 90.0 | 96.4 |
(1)根据素材1中计算20~30s期间,用二氧化硫表示的化学反应平均速率为0.0075mol•L-1•s-1.
(2)根据素材2中分析得到,提高该化学反应限度的途径有增大压强或在一定范围内降低温度.
(3)根据素材1、素材2中分析得到,要实现素材1中SO2的转化率需控制的反应条件是温度为600℃,压强为1MPa.
9.合成氨是人类科学技术上的一项重大突破,其反应原理为
N2(g)+3H2(g)═2ΝΗ3(g)△H=-92.4kJ•mol-1.
(1)T℃时在2L的密闭容器中,N2、H2混合气体充分反应5min后放出热量46.2kJ,
用H2表示的平均速率为0.15molL-1min-1或0.15mol/(Lmin).
(2)合成氨厂可用反应CO(g)+H2O(g)?H2(g)+CO2(g)获得H2,已知该反应的平衡
常数随温度的变化如表,试回答下列问题:
①在800℃发生上述反应,向恒容反应器投入CO2、H2、CO、H2O的物质的量分别为:1mol、1mol、2mol、2mol,此时该反应由正反应方向开始建立平衡.
(选填“正”或“逆”).
②在500℃时进行上述反应,若CO、H2O的起始浓度均为0.020mol•L-1,在该条件下,CO的最大转化率为75%.
③在其他条件不变的前提下,下列措施一定可以提高H2的百分含量的有d;
a.增加CO的用量 b.增加H2O(g)的用量c.增大压强 d.降低温度.
N2(g)+3H2(g)═2ΝΗ3(g)△H=-92.4kJ•mol-1.
(1)T℃时在2L的密闭容器中,N2、H2混合气体充分反应5min后放出热量46.2kJ,
用H2表示的平均速率为0.15molL-1min-1或0.15mol/(Lmin).
(2)合成氨厂可用反应CO(g)+H2O(g)?H2(g)+CO2(g)获得H2,已知该反应的平衡
常数随温度的变化如表,试回答下列问题:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(选填“正”或“逆”).
②在500℃时进行上述反应,若CO、H2O的起始浓度均为0.020mol•L-1,在该条件下,CO的最大转化率为75%.
③在其他条件不变的前提下,下列措施一定可以提高H2的百分含量的有d;
a.增加CO的用量 b.增加H2O(g)的用量c.增大压强 d.降低温度.
16.下列反应既是氧化还原反应,又是吸热反应的是( )
| A. | 铝片与稀H2SO4反应 | B. | Ba(OH)2•8H20与NH4CI的反应 | ||
| C. | 甲烷在02中的燃烧反应 | D. | 灼热的炭与C02反应 |
8.下列物质的水溶液能导电,但属于非电解质的是( )
| A. | FeCl3 | B. | NH3 | C. | NH4HCO3 | D. | Cl2 |
 碱金属元素的单质及其化合物被广泛应用于生产、生活中.
碱金属元素的单质及其化合物被广泛应用于生产、生活中.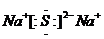 .
.