题目内容
8.(1)在下列空格上填出“<”或“>”①2H2S(g)+3O2(g)═2SO2(g)+2H2O(l)△H=-Q1kJ/mol
2H2S(g)+O2(g)═2S (s)+2H2O(l)△H=-Q2kJ/mol Q1>Q2
②对于平衡m A(g)═n B(g)+p C(g),若降低温度时,A 的转化率增大,则△H1<0;若减压后正反应速率小于逆反应速率,则m>n+p常温下pH=12的烧碱溶液与pH=12氨水分别加水稀释至pH=10,所加水的体积前者<后者
(2)向CuSO4溶液中加入足量氨水可以得到深蓝色溶液,溶液显深蓝色是由于生成了一种离子,请写出该离子的离子符号[Cu(NH3)4]2+.
分析 (1)①题干所给的两个反应均为H2S的燃烧反应,均为放热反应,当H2S完全燃烧时放热更多;
②若降低温度时,A 的转化率增大,平衡右移,据此分析反应吸放热;减压后正反应速率小于逆反应速率,即减压后平衡左移,据此分析m与n+p的大小关系;根据氨水是弱碱,加水稀释时NH3•H2O的电离平衡被促进来分析;
(2)硫酸铜先和氨水反应生成氢氧化铜,氢氧化铜和氨水反应生成络合物,根据反应写出离子符号.
解答 解:(1)①题干所给的两个反应均为H2S的燃烧反应,均为放热反应,当H2S完全燃烧时放热更多,即Q1>Q2,故答案为:>;
②若降低温度时,A 的转化率增大,平衡右移,故正反应方向放热,即△H1<0;减压后正反应速率小于逆反应速率,即减压后平衡左移,则逆反应方向是气体体积增大的方向,故有:m>n+p;氨水是弱碱,加水稀释时NH3•H2O的电离平衡被促进,电离出更多的OH-,故若想加水稀释后溶液的pH均为10,则必须氨水溶液中所加的水的体积更大,即所加水的体积前者<后者,故答案为:<,>,<;
(2)氨水和硫酸铜反应生成氢氧化铜蓝色沉淀,当氨水过量时,氨水和氢氧化铜反应生成可溶性的铜氨络合物,则由蓝色难溶物得到深蓝色溶液的离子方程式为Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,故该离子的离子符号为[Cu(NH3)4]2+.故答案为:[Cu(NH3)4]2+.
点评 本题考查了反应放出热量的大小比较以及根据平衡移动方向来分析反应吸放热等问题,难度不大,

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图.下列叙述正确的是( )
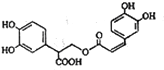

| A. | 迷迭香酸的分子式为C18H15O8 | |
| B. | 迷迭香酸可以发生加成、取代、显色反应 | |
| C. | lmol迷迭香酸跟H2反应,最多消耗6mol H2 | |
| D. | lmol迷迭香酸在NaOH溶液中反应,最多消耗5mol NaOH |
19.下列说法正确的是( )
| A. | 右列图标均与燃烧和爆炸有关 | |
| B. | 棉、麻、蚕丝、羊毛及合成纤维都属于纤维,但均不含纤维素 | |
| C. | 科学家用单个分子制成了“纳米车”,它能在人工操纵下运输药物分子到病源处释放以杀死癌细胞.“纳米车”说明在一定条件下,分子的热运动须在人工操纵下才能进行 | |
| D. | 捕获工业排放的CO2,既能降低地球的温室效应又能用来合成聚碳酸酯可降解塑料,实现碳的循环利用 |
16.甲、乙是由短周期元素组成的常见物质或微粒,在中学化学中有许多物质或微粒能满足下列相互转化关系:甲$\stackrel{H+}{→}$乙$\stackrel{OH-}{→}$甲.下列说法正确的是( )
| A. | 甲有可能是AlO2- 也有可能是Al3+ | |
| B. | 若乙为无色无味气体,则甲一定是CO32- | |
| C. | 若甲是具有刺激性气味的气体,则甲、乙具有相同的电子数 | |
| D. | 若甲、乙均为离子,甲、乙两种离子在同一溶液中一定不能大量共存 |
3.下列说法正确的是( )
| A. | 含有共价键的物质一定是共价化合物 | |
| B. | 分子中只有共价键的化合物一定是共价化合物 | |
| C. | 离子化合物中一定没有共价键 | |
| D. | 离子化合物一定含有金属元素 |
13.溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是( )
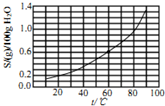

| A. | 25℃时,溴酸银微溶于水 | |
| B. | 溴酸银溶解度随温度升高而增大 | |
| C. | 60℃时溴酸银的Kap约等于2.5×10-4 | |
| D. | 往溴酸银浊液中滴加NaI有黄色固体生成 |
17.下列说法中正确的是( )
| A. | 分液时,水溶液一定从下口放出 | |
| B. | 蒸馏时,如果温度计水银球下端高于蒸馏烧瓶支管口上沿,收集到的馏分沸点偏高 | |
| C. | 滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面 | |
| D. | 量取20.0mL浓硫酸时,俯视读数,所取液体体积偏大 |
12.0.2mol•L-1的醋酸溶液中,各种离子浓度的关系正确的是( )
| A. | [CH3COOH]>[H+]>[CH3COO-]>[OH-] | B. | [H+]>[CH3COO-]>[CH3COOH]>[OH-] | ||
| C. | [CH3COOH]>[CH3COO-]>[H+]>[OH-] | D. | [CH3COOH]>[H+]>[OH-]>[CH3COO-] |
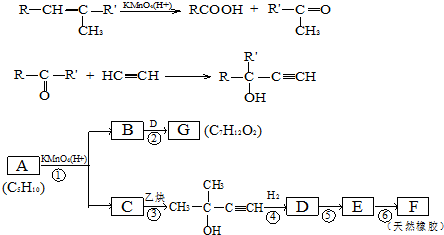
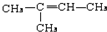 ,CCH3COCH3,ECH2=C(CH3)CH=CH2
,CCH3COCH3,ECH2=C(CH3)CH=CH2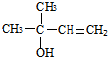 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$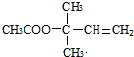 +H2O;
+H2O; .
.