16.下列叙述正确的是( )
①热稳定性:H2O>HF>H2S
②熔点:Al>Na>Hg
③ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤元素的非金属性越强,其氧化物对应的水化物的酸性就越强
⑥已知2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ.mol-1则H2的燃烧热为285.8 kJ.mol-1
⑦因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N.
①热稳定性:H2O>HF>H2S
②熔点:Al>Na>Hg
③ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤元素的非金属性越强,其氧化物对应的水化物的酸性就越强
⑥已知2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ.mol-1则H2的燃烧热为285.8 kJ.mol-1
⑦因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N.
| A. | 只有③⑤⑦ | B. | 只有①⑥⑦ | C. | 只有②③④ | D. | 只有②④⑥ |
12.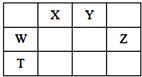 如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22.下列说法正确的是( )
如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22.下列说法正确的是( )
 如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22.下列说法正确的是( )
如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22.下列说法正确的是( )| A. | X、Y、Z三种元素最低价氢化物的沸点依次升高 | |
| B. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| C. | 物质WY2、W3X4均有熔点高、硬度大的特性 | |
| D. | T元素的单质不具有半导体的特性,T与Z元素可形成化合物TZ4 |
11.有人设计将两根Pt丝作电极插入KOH溶液中,然后向两极上分别通入甲烷和氧气而构成燃料电池.该电池中反应的化学方程式:CH4+2O2+2KOH═K2CO3+3H2O,则关于此燃料电池的下列说法正确的是(一个电子带电量为1.6×10-19 C)( )
| A. | 通入甲烷的电极为电池的正极,通入氧气的电极为负极 | |
| B. | 在标准状况下,每消耗5.6 L O2,可向外提供8.3×104 C的电量 | |
| C. | 通入甲烷电极的电极反应为:CH4+10OH--8e-═CO32-+7H2O | |
| D. | 放电一段时间后,溶液pH升高 |
8.用FeCl3溶液腐蚀印刷电路板上铜箔的反应是:2Fe3++Cu=2Fe2++Cu2+.下列有关说法正确的是( )
0 169103 169111 169117 169121 169127 169129 169133 169139 169141 169147 169153 169157 169159 169163 169169 169171 169177 169181 169183 169187 169189 169193 169195 169197 169198 169199 169201 169202 169203 169205 169207 169211 169213 169217 169219 169223 169229 169231 169237 169241 169243 169247 169253 169259 169261 169267 169271 169273 169279 169283 169289 169297 203614
| A. | Cu是还原剂,被腐蚀 | B. | Fe2+是氧化产物 | ||
| C. | 该反应是置换反应 | D. | 该反应属于离子反应 |
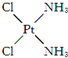 ,具有抗癌作用;反铂的结构简式为
,具有抗癌作用;反铂的结构简式为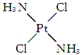 ,无抗癌作用.顺铂和反铂的物理性质有很大差异,其中只有一种易溶于水,请你通过所学知识判断哪一种易溶于水,并说明理由:顺式结构,顺铂易溶于水,因为它是极性分子,易溶于极性溶剂.
,无抗癌作用.顺铂和反铂的物理性质有很大差异,其中只有一种易溶于水,请你通过所学知识判断哪一种易溶于水,并说明理由:顺式结构,顺铂易溶于水,因为它是极性分子,易溶于极性溶剂.