题目内容
9.(1)在Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O反应中,请用双线桥法标出电子得失情况,并指出氧化剂、还原剂,氧化产物、还还原产物.氧化剂H2SO4;还原剂Cu
氧化产物CuSO4;还原产物SO2
(2)在 2H2S+O2=2S+2H2O反应中,请用单线桥法标出电子得失情况,被氧化的元素是S;被还原的元素是O.
分析 (1)S元素化合价降低,被还原,H2SO4为氧化剂,Cu元素化合价升高,被氧化,Cu为还原剂;
(2)S元素化合价升高,被氧化,O元素化合价降低,被还原.
解答 解:(1)该氧化还原反应中,得电子的元素是硫,化合价降低2价,H2SO4为氧化剂,SO2为还原产物,失电子的元素是铜,化合价升高2价,所以转移电子2mol,Cu为还原剂,CuSO4为氧化产物,如下所示: ,
,
故答案为: ;H2SO4;Cu;CuSO4;SO2;
;H2SO4;Cu;CuSO4;SO2;
(2)S元素化合价升高,被氧化,O元素化合价降低,被还原,电子转移方向和数目为 ,
,
故答案为: ;S;O.
;S;O.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,注意从化合价角度分析,侧重氧化还原反应转移电子表示方法的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.在1.01×105Pa下,1mol的下列物质的体积不同的是( )
| A. | 10℃时的HCl和H2O | B. | 400K时的水和CO2 | ||
| C. | 20℃时的氧气和空气 | D. | 常温下的H2和N2 |
17.下表中的实验内容不能达到实验目的或不能得出相应实验结论的是( )
| 编号 | 实验内容 | 实验目的或实验结论 |
| ① | 利用一束强光照射矾溶液,产生光亮的“通路”. | 说明明矾一定发生了水解 |
| ② | 向bmL0.1mol/LAgNO3溶液中滴加1mL0.1mol/LNaCl溶液,有白色沉淀生成,再向其中滴加1mL0.1mol/LKI溶液,有黄色沉淀生成. | 验证AgCl的溶解度比AgI大 |
| ③ | 向KI溶液中滴入CuSO4溶液,有白色沉淀生成,但无气体产生,再加入四氧化碳振荡,四氧化碳层呈紫色 | 说明白色沉淀可能为CuI |
| ④ | 室温下,分别向2支试管中加入相同体积,相同浓度的Na2S2O3溶液,再分别加入等体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
| ⑤ | 将铁粉投入到盛有稀HNO3的试管中,充分反应后滴入几滴KSCN溶液无明显现象 | 说明HNO3将Fe氧化成Fe2+ |
| A. | ①③ | B. | ③⑤ | C. | ③④ | D. | ②⑤ |
1.下列反应,既是氧化还原反应又是离子反应的是( )
| A. | 炭在氧气中燃烧 | B. | 二氧化碳通入澄清石灰水中 | ||
| C. | 氯化钠溶液中滴入硝酸银溶液 | D. | 锌粒投入硫酸中 |
18.下列说法正确的是( )
| A. | 90℃时,纯水的pH等于7 | |
| B. | 配制FeCl3溶液,为了抑制水解,常加稀硫酸 | |
| C. | 已知一种c (H+)=1×10-3mol/L的酸和一种c (OH-)=1×10-3mol/L碱溶液以等体积混合后,溶液呈酸性,其原因是浓的弱酸和稀碱反应所致 | |
| D. | 在Na2S溶液中,离子浓度的关系是:c (Na+)>c (S2-)>c (HS-)>c (OH-)>c (H+) |
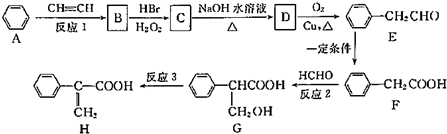
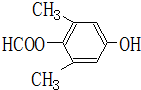
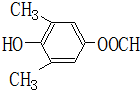
19.某有机物A的结构简式如图所示.下列叙述正确的是( )


| A. | A不能和新制Cu(OH)2悬浊液反应 | |
| B. | A中含有2种含氧官能团 | |
| C. | A能够发生加成、取代和消去反应 | |
| D. | 1molA和足量的NaOH溶液反应,消耗2molNaOH |

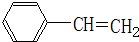 .
.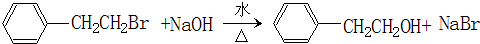 .
. 、
、 .
.