题目内容
12.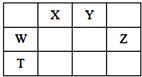 如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22.下列说法正确的是( )
如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22.下列说法正确的是( )| A. | X、Y、Z三种元素最低价氢化物的沸点依次升高 | |
| B. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| C. | 物质WY2、W3X4均有熔点高、硬度大的特性 | |
| D. | T元素的单质不具有半导体的特性,T与Z元素可形成化合物TZ4 |
分析 W、X、Y、Z为短周期元素,由元素在周期表中位置可知,X、Y处于第二周期,W、Z处于第三周期,令W的最外层电子数为a,则X、Y、Z最外层电子数分别为a+1、a+2、a+3,故a+a+1+a+2+a+3=22,解得a=4,故W为Si、X为N、Y为O、Z为Cl、T为Ge,据此解答.
解答 解:W、X、Y、Z为短周期元素,由元素在周期表中位置可知,X、Y处于第二周期,W、Z处于第三周期,令W的最外层电子数为a,则X、Y、Z最外层电子数分别为a+1、a+2、a+3,故a+a+1+a+2+a+3=22,解得a=4,故W为Si、X为N、Y为O、Z为Cl、T为Ge.
A.X、Y、Z三种元素最低价氢化物分别为氨气、水、HCl,常温下水为液态,氨气、HCl为气体,故水的沸点最高,氨气分子之间都存在氢键,沸点比HCl的高,故A错误;
B.N、O和H形成的化合物硝酸铵中既有离子键、又有共价键,故B错误;
C.物质SiO2、Si3N4均为原子晶体,均有熔点高、硬度大的特性,故C正确;
D.Ge元素的单质具有半导体的特性,与Cl元素可形成化合物GeCl4,故D错误,
故选:C.
点评 本题考查位构性的知识,题目难度中等,把握短周期及最外层电子数的关系推断元素为解答的关键,涉及氢键、化学键、晶体类型及性质、元素周期律等,综合性较强,充分考查了学生灵活应用基础知识的能力.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案
相关题目
8.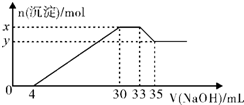 在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示,下列叙述不正确的是( )
在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示,下列叙述不正确的是( )
 在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示,下列叙述不正确的是( )
在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示,下列叙述不正确的是( )| A. | 原溶液中n(Mg2+):n(Al3+)=5:1 | B. | 原溶液的c(H+)=0.1mol•L-1 | ||
| C. | x与y的差值为0.01mol | D. | 原溶液中c(Cl-)=0.85mol•L-1 |
3.25℃时,向10ml0.01mol/LKOH溶液中滴加0.01mol/L苯酚溶液,混合溶液中粒子浓度关系正确的( )
| A. | pH>7时,c(C6H5O-)>c(K+)>c(H+)>c(OH-) | |
| B. | pH<7时,c(K+)>c(C6H5O-)>c(H+)>c(OH-) | |
| C. | V[C6H5OH(aq)]=20ml时,c(C6H5O-)+c(C6H5OH)=2c(K+) | |
| D. | V[C6H5OH(aq)]=10ml时,c(K+)=c(C6H5O-)>c(OH-)=c(H+) |
20.下列有关元素递变情况的说法正确的是( )
| A. | Na、Al、Mg的还原性依次增强 | B. | Na、K、Rb的金属性依次减弱 | ||
| C. | Al、Si、P的原子半径依次增大 | D. | B、C、N的最高正化合价依次升高 |
4.关于元素周期表,下列叙述中不正确的是( )
| A. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| B. | 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 | |
| C. | 在金属元素区域可以寻找制备新型农药材料的元素 | |
| D. | 过渡元素是副族和第Ⅷ族元素的总称 |
1.N2O5是一种新型硝化剂,其性质和制备受到人们的关注.一定温度下,在2L固定容积的密闭容器中发生反应:2N2O5(g)?4NO2(g)+O2(g)△H>0,反应物和部分生成物的物质的量随反应时间变化的曲线如图所示,下列说法中不正确的是( )
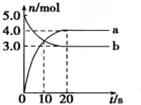

| A. | 曲线a表示NO2的物质的量随时间的变化 | |
| B. | 10s时,v(正)>v(逆) | |
| C. | 20s时反应达到平衡 | |
| D. | 0~20s内平均反应速率v(O2)=0.05mol•L-1•s-1 |
2.下列化学用语描述中不正确的是( )
| A. | 中子数为20的氯原子:3717Cl | |
| B. | K2O的电子式: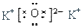 | |
| C. | HCO3-的电离方程式:HCO3-+H2O?CO32-+H3O+ | |
| D. | 比例模型 可以表示CO2分子或SiO2 可以表示CO2分子或SiO2 |